
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
解析试题解析:根据B可与A、C、D生成化合物甲、乙、丙,原子序数按B、D、C、A、E依次增大,且乙、丙为10电子分子,可判断B为H2。结合C与丙反应生成乙,且乙可与A单质反应,推断出C为O2,D为N2,则乙为H2O,丙为NH3。结合A可与乙(H2O)反应,且产物戊光照可得C(O2)和甲,可推出A为Cl2,戊为HClO,甲为HCl。A(Cl2)与E反应生成己,己又可与E反应生成庚,可推出E为变价金属Fe,己为FeCl3,则庚为FeCl2。
科目:高中化学
来源:
题型:实验题
(10分)某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
科目:高中化学
来源:
题型:推断题
有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白:
科目:高中化学
来源:
题型:推断题
图中各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥,B、D常温常压下是气体。请回答下列问题:
科目:高中化学
来源:
题型:推断题
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
科目:高中化学
来源:
题型:推断题
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
科目:高中化学
来源:
题型:推断题
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z原子与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
科目:高中化学
来源:
题型:推断题
【化学——选修5:有机化学基础】(15分)
科目:高中化学
来源:
题型:推断题
(18分)A和B在一定条件下可合成芳香族化合物E,G在标准状况下是气体,此情况下的密度为1.25g/L。各物质间相互转化关系如下所示:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
(1) O
(2)实验室用MnO2和浓盐酸反应制取氯气。
(3)H2与N2形成的原子个数比为2:1的化合物为N2H4。
(4)根据Cl2与NH3反应生成N2和HCl,可写出方程式。
(5)8gFe与Cl2反应放出QkJ热量,即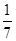 molFe可放出QkJ热量,据此可写出热化学方程式,注意题中强调热量在常温下测定,常温下Fe和FeCl3均为固体。
molFe可放出QkJ热量,据此可写出热化学方程式,注意题中强调热量在常温下测定,常温下Fe和FeCl3均为固体。
(6)实验室配制FeCl2溶液时,为防止Fe2+水解,需将FeCl2晶体在盐酸中溶解,然后稀释,并加适量铁粉。
考点:考查元素化合物的结构和性质,热化学方程式书写,电子式,溶液配制。

考前模拟预测试卷系列答案
同步词汇训练系列答案
优加学案创新金卷系列答案
单元自测系列答案
冠亚中考模拟试题系列答案
学业水平考试标准测评卷系列答案
培优应用题卡系列答案


同步作文与创新阅读系列答案
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
Ⅱ.测定中和热:(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。 名称
托盘天平
小烧杯
坩埚钳
玻璃棒
药匙
量筒
仪器






序号
a
b
c
d
e
f
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。①请填写下表中的空白:
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。 实验
次数
起始温度t1/℃
终止温度
t2/℃
温度差平均值
(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差 B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度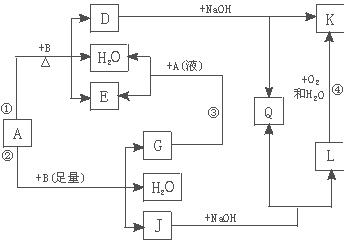
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答): 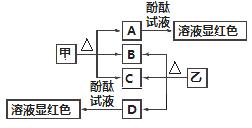
(1)甲的俗名是________。
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,其原理________(填“相同”或“不相同”)。
(3)甲在潮湿的空气中会缓慢分解,A会吸收空气中的水分:A+nH2O===A·nH2O(n为平均值,n≤10),取没有妥善保管的甲样品9.16 g,溶于水制成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的B的体积(标准状况)如下表:(溶于水中的B不计)
则:盐酸的体积(mL)
4
8
15
20
50
120
150
生成B的体积(mL)
0
0
112
224
896
2240
2240
① 稀盐酸的物质的量浓度为__________________________________。
② 样品中的成分及其物质的量分别为__________________________________。
请回答下列问题:
(1)写出下列物质的化学式:B_________、丙_________、乙_________。
(2)写出下列反应的离子方程式:
反应①_____________________________________________;
反应⑤_____________________________________________;
反应⑥_____________________________________________。A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。
B元素原子的核外p电子数比s电子数少1。
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol
I4=10540kJ/mol
D原子核外所有p轨道全满或半满。
E元素的主族序数与周期数的差为4。
F是前四周期中电负性最小的元素。
G在周期表的第七列。
(1)已知BA5为离子化合物,写出其电子式__________________________________。
(2)B的基态原子中能量最高的电子,其电子云在空间有①_________个伸展方向,原子轨道呈②__________________形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为: 
该同学所画的电子排布图违背了_________________________。
(4)G位于①_________族②________区,价电子排布式为③______________________。
(5)DE3分子中,中心原子的杂化方式为①_____________,其分子的立体构型为②_____________。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为_____________cm。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_____、_______;杂化轨道分别是________、_________;a分子的立体结构是____________;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体;
(3)X的氧化物与Y的氢化物中,分子极性较小的是(填分子式) ;
(4)Y与Z比较,电负性较大的是____________;
(5)W的元素符号是 ,其+2价离子的核外电子排布式是 。
化合物H可用以下路线合成: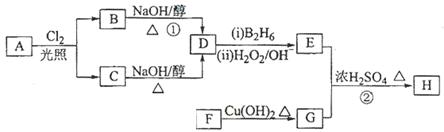
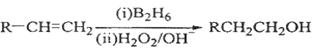
已知:
请回答下列问题:
(1)标准状况下11.2 L烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3—苯基—1—丙醇。F的结构简式是 ;
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为 ;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式
。

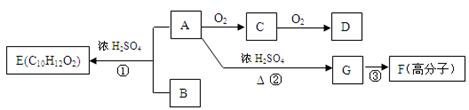
 请回答下列问题:
请回答下列问题: (1)G中的官能团是 (用化学式表示),D中的官能团名称是 ,
(1)G中的官能团是 (用化学式表示),D中的官能团名称是 ,
F的结构简式 。 (2)指出反应类型:① ,② ,③ 。
(2)指出反应类型:① ,② ,③ 。 (3)满足下列条件的B的同分异构体有 种。
(3)满足下列条件的B的同分异构体有 种。
①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基 (4)写出化学方程式:A→C ;
(4)写出化学方程式:A→C ; C与新制的氢氧化铜悬浊液反应: 。
C与新制的氢氧化铜悬浊液反应: 。
版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。
ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号