
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B_________、丙_________、乙_________。
(2)写出下列反应的离子方程式:
反应①_____________________________________________;
反应⑤_____________________________________________;
反应⑥_____________________________________________。
(1)Al、HCl、Cl2
(2)2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Fe2+=2Fe3++2Cl- ;Fe3++3OH-=Fe(OH)3↓
解析试题分析:金属A的焰色反应是黄色,说明A是Na。钠和水反应生成氢氧化钠和氢气,则甲是氢气,D是氢氧化钠。乙是黄绿色气体,则乙是氯气。氯气和氢气化合生成氯化氢,则丙是氯化氢。氯化氢溶于水生成盐酸,则E是盐酸。红褐色沉淀H应该是氢氧化铁,氢氧化钠和G反应生成氢氧化铁,所以G是氯化铁。F和氯气反应生成氯化铁,则F是氯化亚铁,因此金属C是铁。
考点:考查无机框图题的判断
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:单选题
下列原子结构模型与科学家对应不正确的一项是:
| A.阿伏加德罗的原子学说 |
| B.汤姆生的“葡萄干面包式”原子结构模型 |
| C.卢瑟福的带核原子结构模型 |
| D.玻尔的核外电子在一定轨道上运动的观点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
废电池造成污染的问题日益受到关注,集中处理废电池的首要目的是
| A.回收石墨电极 |
| B.回收电池外壳的金属材料 |
| C.防止电池中渗泄的电解液腐蚀其他物品 |
| D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取A12O3、K2CO3等物质,工艺流程如下:
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
【化学选修2:化学与技术】(15分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。
(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出。
①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为 (写化学式)。在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式: 。
②若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如下表所示(x和y均大于0)。
各离子的量与E的体积的关系
I.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为 。
II.x= ,y= (填具体数据)。
III.当通入E的体积为11.2L时,该溶液中c(Na+)=____ mol·L-1(通入E后溶液的体积变化忽略不计)。
(2)用H2O2可除去工业尾气中的Cl2,相关反应:
H2O2(1)+Cl2(g) 2HCl(g)+O2(g)△H>0.
2HCl(g)+O2(g)△H>0.
①为了提高H2O2的除氯效果,采取的措施最好的是 (只改变一种条件),其原因是: 。
(g)+ O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
Cl2(g)+ H2(g)= 2HCl(g), △H3 = -184.6kJ·mol-l
则H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(14分)F是治疗慢性髓样白血病的新药伊马替尼的中间体,可由下列路线合成: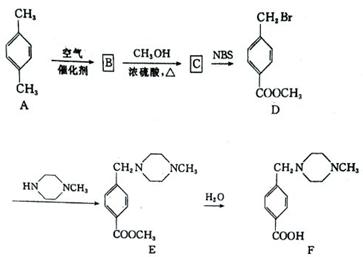
(1)写出下列反应的反应类型
A→B D→E
(2)满足下列条件的C的同分异构体有 种,写出其中一种的结构简式
①是二取代苯 ②含有醛基 ③能与FeCl3溶液发生显色反应
(3) NBS(N-溴代丁二酰亚胺通常情况下是一种白色固体),是有机合成中一种很有用的溴代剂,其结构简式为 ,则反应C→D的化学方程式为 ,
,则反应C→D的化学方程式为 ,
下列有关说法中错误的是____(填字母)。
| A.该反应是加成反应 | B.NBS的分子式为C4H4BrNO2 |
| C.加入适当的溶剂可以加快反应的反应速率 | |
| D.C与液溴反应也能转化为D,但可能会造成污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com