
【化学选修2:化学与技术】(15分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
(15分)
(1)3NaClO3+3H2SO4===HClO4+2ClO2↑+3NaHSO4+H2O(3分);降低NaHSO4的溶解度,使NaHSO4结晶析出(2分);高氯酸的沸点低(2分)
(2)2ClO2+SO2+4OH-===2ClO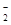 +SO
+SO +2H2O (2分)
+2H2O (2分)
(3)H2O2有还原性也能把ClO2还原为NaClO2 (2分)
(4)强氧化性(2分);Cl2+2OH-===ClO-+Cl-+H2O (2分)
解析试题分析:(1)根据流程图可知,氯酸钠与浓硫酸反应生成NaHSO4、二氧化氯、高氯酸还有谁生成,化学方程式为3NaClO3+3H2SO4===HClO4+2ClO2↑+3NaHSO4+H2O;经冷却、过滤后得硫酸氢钠的晶体,所以冷却的目的是降低降低NaHSO4的溶解度,使NaHSO4结晶析出;用蒸馏法分离出高氯酸的原因是高氯酸的沸点是90 ℃较低,可用蒸馏法蒸出。
根据流程图可知二氧化氯与二氧化硫、氢氧化钠溶液反应生成NaClO2,Cl元素的化合价降低,则S元素的化合价升高,所以产物中还有硫酸钠,所以反应器II中发生的离子方程式为2ClO2+SO2+4OH-===2ClO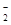 +SO
+SO +2H2O ;
+2H2O ;
用过氧化氢代替二氧化氯,是因为过氧化氢也有还原性,也能和二氧化氯、氢氧化钠溶液反应生成NaClO2,
作消毒剂的物质都具有共同点就是具有强氧化性;氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,离子方程式为Cl2+2OH-===ClO-+Cl-+H2O 。
考点:考查Cl元素及其化合物的性质,离子方程式的判断与书写


科目:高中化学 来源: 题型:单选题
化学与生活密切相关,以下说法不正确的是
| A.CaO能与SO2反应,可作燃煤的脱硫剂 |
| B.食醋可用于除去暖水瓶中的水垢 |
| C.明矾水解时产生具有吸附性的胶体粒子,可作净水剂 |
| D.铁在空气中易形成致密的氧化膜,可用来运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下: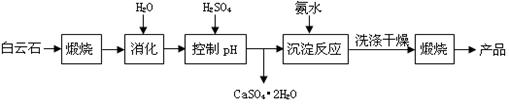
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 (填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:
①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 ;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B_________、丙_________、乙_________。
(2)写出下列反应的离子方程式:
反应①_____________________________________________;
反应⑤_____________________________________________;
反应⑥_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
下图为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题
(1)元素⑧形成的简单阴离子的结构示意图为____;元素④、⑥、⑦形成的简单离子的半径由大到小的顺序是 (用离子符号表示)。
(2)元素③和④可以形成多种化合物,其中化合物甲为这些化合物中相对分子质量最小的。若将化合物甲与元素④的单质按物质的量之比为4:1通人含足量由元素①、④和⑥组成的化合物乙的水溶液中,气体恰好完全反应且生成的盐只有一种,其反应的化学方程式为________。
(3)元素②和④组成的一种化合物与元素④的单质和化合物乙的水溶液在一定条件下可形成燃料电池,写出该燃料电池负极的电极反应式 .
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
①X溶液与Y溶液反应的离子方程式为___ _。
②N→⑦的单质反应的化学方程式为___ _。
③M的水溶液显酸性,用离子方程式解释其原因___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
有五种原子序数在36以内的元素A、B、C、D、E,它们的原子序数依次增大,A原子的最外层电子数等于其电子层数,A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;D和C的最高价氧化物对应水化物的酸性前者强于后者;E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,这两种化合物的摩尔质量相差32。试回答下列问题:
(1)E在周期表中的位置是 ,基态B原子的价电子排布式 。
(2)写出CD2的电子式 ,根据价层电子对互斥(VSEPR)理论推测,CD2分子的空间构型为 ,该分子是 分子(填“极性”或“非极性”)。
(3)通常情况下,AB3为无色有刺激性气味的液体,沸点303.8K,熔点193K。AB3固态时的晶体类型为 ;其水溶液有弱酸性,它的电离方程式为 。
(4)下列性质可作为比较C、D两元素非金属性强弱依据的是 (填编号)。
①C、D的最高价氧化物对应水化物的酸性强弱
②C、D的气态氢化物的水溶液的酸性强弱
③C、D的气态氢化物的稳定性强弱
④C、D的简单离子是否易被E3+氧化
⑤相同条件下,C、D的钠盐溶液的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(14分)含扑热息痛高分子药物F具有长效性、稳定性,毒副作用小,而且可以实现药物的缓控释。F的一种合成流程图如下图所示:

请回答下列问题:
(1)①是加成反应,则A的结构简式为_______,B中官能团的名称是________。
(2)C的名称是____________。反应②~⑥中,属于取代反应的是_________。
(3)反应⑤的化学方程式是__________________________。
(4)F与足量NaOH溶液发生反应的化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com