
(12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: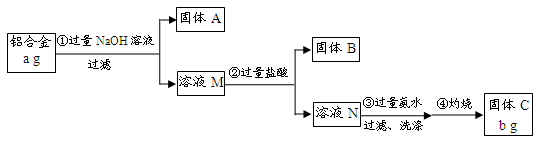
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
(1)Mg、Cu
(2)SiO32-+2H+=H2SiO3↓ Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+
(3)取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净。
(4)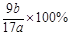 (5)C D (每空2分)
(5)C D (每空2分)
解析试题分析:⑴根据铝合金的主要成分为铝、镁、铜、硅,只有铝、硅与过量NaOH溶液反应溶解,则过滤所得固体A的成分是Mg、Cu;
⑵溶液M中主要含有NaAlO2、Na2SiO3,加入过量盐酸,Na2SiO3与盐酸反应生成H2SiO3沉淀(固体B);溶液N中主要含有AlCl3,步骤③加入过量氨水与其反应生成Al(OH)3沉淀;
⑶步骤③洗涤沉淀表面上的可溶性杂质NaCl、NH4Cl;用AgNO3溶液可检验沉淀是否洗涤干净;
⑷据题意知固体C为Al2O3,据铝原子守恒可计算出样品中铝的质量分数=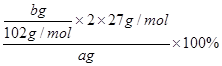 =
=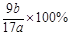 ;
;
⑸A项第①步中加入NaOH溶液不足,铝不能全部溶解,会导致结果偏小;B项第②步中加入盐酸不足时,氢氧化铝不能完全溶解,会导致结果偏小;C项第③步中沉淀未用蒸馏水洗涤会导致氧化铝含有杂质,其质量偏大,会使测定结果偏大;D项第④步对沉淀灼烧不充分,会导致氧化铝中含有氢氧化铝,将导致铝的含量偏大,综上分析可确定C、D项正确。
考点:考查化工流程图。


科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.将FeCl3溶液加热蒸干得到FeCl3固体 |
| B.向Fe(NO3)2溶液中加少量盐酸,无明显现象 |
| C.向氢氧化镁悬浊液中滴加FeCl3溶液,无明显现象 |
| D.向FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Al、Cu都是重要的金属元素。下列说法正确的是
| A.两者对应的氧化物均为碱性氧化物 |
| B.两者的单质都能与稀硫酸反应产生氢气 |
| C.常温条件下,两种金属都能溶解于浓硝酸中 |
| D.用惰性电极电解AlCl3、CuCl2的水溶液均可得到氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。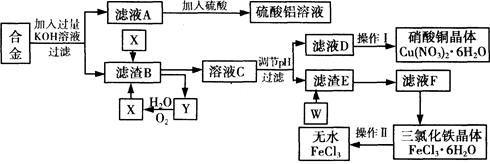
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式: 。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作) 。
(3) 写出试剂X的名称 。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)用氯化铝溶液与氢氧化钠溶液反应时:
(1)当Al3+的物质的量与OH-的物质的量之比为 时,Al(OH)3沉淀量最多;
(2)当Al3+的物质的量与OH-的物质的量之比 时,Al(OH)3全部溶解;
(3)当Al3+的物质的量与OH-的物质的量之比 或 时,Al(OH)3沉淀量为最多沉淀量的一半。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的—部分,请参照元素①一⑨在表中的位置,回答下列问题。
(1)第三周期中元素非金属性最强的元素的原子结构示意图是___________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是___________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________________。
(4)下列可以判断⑤和⑥金属性强弱的是______________________(填序号)。
A.单质的熔点⑤比⑥低 B.化合价⑤比⑥低
C.单质与水反应⑤比⑥剧烈 D.最高价氧化物的水化物的碱性⑤比⑥强
(5)含有上述元素的物质间存在以下转化: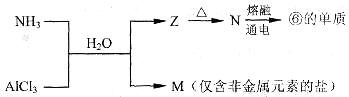
A.M的化学式是___________。
B.N生成⑥的单质反应的化学方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):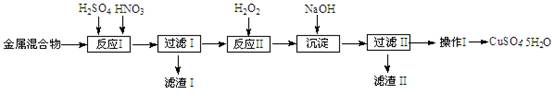
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
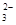 = 2Iˉ+S4O
= 2Iˉ+S4O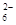
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。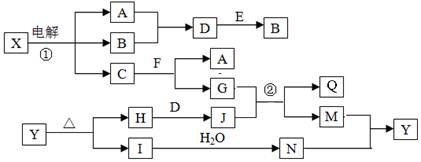
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质:E、H、I为氧化物,E为黑色固体,H为红棕色粉末,I为红棕色气体;M为红褐色沉淀,Q为白色胶状物质。
请回答下列问题:
(1)组成单质F的元素在周期表中的位置是______;C中存在的化学键类型为____;E的化学式是___。
(2)A在B中燃烧的现象是_______ 。
(3) D+E→B的反应中,被氧化与被还原的物质的物质的量之比是_______。
(4)反应①的化学方程式为___________________________________ 。
(5)反应②的离子方程式为___________________________________。
(6)Y受热分解可生成H、I和氧气,.写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: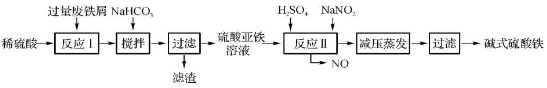
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com