
【题目】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
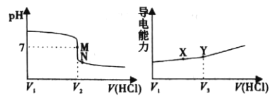
A.M点对应溶液中c(NH4+)=c(Cl-)
B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大
C.根据溶液pH和导电能力的变化可判断V2<V3
D.M→N过程中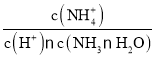 不变
不变
【答案】B
【解析】
A.常温下,M点溶液呈中性,则溶液中c(OH-)=c(H+),溶液中存在电荷守恒c(NH4+)+c(OH-)=c(H+)+ c(Cl-),所以c(NH4+)=c(Cl-),A正确;
B.X到Y溶液导电性增强主要是溶液中c(H+)、c(NH4+)增大,B错误;
C.NH4Cl是强酸弱碱盐,水解使溶液呈酸性,要使酸碱混合溶液呈中性,则M点NH3·H2O物质的量n(NH3·H2O)大于n(HCl),即氨水有剩余,导电能力中Y点为酸碱恰好完全反应点,Y点n(HCl)=n(NH3·H2O),则V2<V3,C正确;
D.M→N过程中,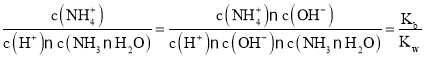 ,物质NH3·H2O的电离平衡常数及水的离子积常数只与温度有关,温度不变,则Kb、Kw不变,因此
,物质NH3·H2O的电离平衡常数及水的离子积常数只与温度有关,温度不变,则Kb、Kw不变,因此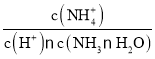 不变,D正确;
不变,D正确;
故错误选项是B。


科目:高中化学 来源: 题型:
【题目】实验室中可利用反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O来制取氯气。
(1)用双线桥(或单线桥)标出下列反应中电子转移的方向和数目:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O__________
(2)该反应中氧化剂是______,氧化产物是________。若有1 mol KMnO4参加反应,转移的电子的物质的量是______mol,被氧化的HCl的物质的量是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以A为原料合成该药物的路线如图:

(1)A的化学名称是__,C中的官能团除了氯原子,其他官能团名称为__。
(2)A分子中最少有__原子共面。
(3)C生成D的反应类型为__。
(4)A与新制Cu(OH)2反应的化学方程式为__。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有__种。
①除苯环之外无其他环状结构;②能发生银镜反应。③苯环上有只有两个取代基。
其中核磁共振氢谱中有4个吸收峰,且峰值比为2∶2∶2∶1的结构简式为__。
(6)已知:
![]()
![]()
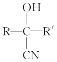 ,写出以苯甲醇为有机原料制备化合物
,写出以苯甲醇为有机原料制备化合物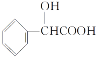 的合成路线(无机试剂任选)__。
的合成路线(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是优良的溶剂,在工业上可用作洗涤剂、润滑剂,其合成线路:
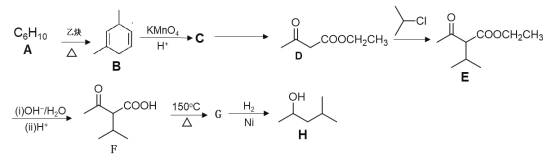
已知:①![]()
②![]()
③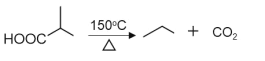
请回答下列问题:
(1)H的名称为___。用*标出F中的手性碳原子__(碳原子上连有4个不同原子或基团时,该碳称为手性碳)
(2)A的结构简式为___。
(3)D→E的化学方程式为___。
(4)F中含有官能团的名称为__。G→H的反应类型为__。
(5)写出符合下列条件的D的同分异构体的结构简式为__。
①能与NaHCO3溶液反应放出CO2②能发生银镜反应③核磁共振氢谱有4组峰且峰面积之比为6∶2∶1∶1
(6)请设计由![]() 和乙烯(CH2=CH2)为起始原料,制备
和乙烯(CH2=CH2)为起始原料,制备![]() 的合成路线__(无机试剂任选)。
的合成路线__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁的质量?___
(2)原稀硫酸的物质的量浓度?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废铜屑(含铜、铝等)制备CuSO4·5H2O晶体,制备流程如图:
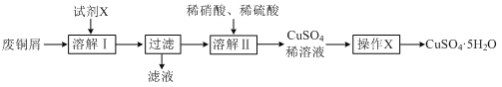
(1)“溶解Ⅰ”过程中所用试剂X为___。(填写试剂名称)
(2)“溶解Ⅱ”发生反应的离子方程式为___。
(3)“操作X”包括___、过滤、无水乙醇洗涤、低温干燥。
(4)某种杀菌剂中含CuSO4和Cu(OH)2,为测定其组成,兴趣小组设计如下实验:取一定量的杀菌剂,将其溶于足量的稀盐酸中,然后向其中加入足量的BaCl2溶液,过滤干燥后得白色固体2.33g。然后向滤液中滴加1.00mol·L-1的Na2H2Y(EDTA)溶液,反应至终点时消耗Na2H2Y溶液30.00 mL(离子方程式为Cu2++H2Y2-=CuY2-+2H+)。
①由准确称量后的EDTA固体配制100mL1.00mol·L-1的EDTA溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②通过计算确定杀菌剂中CuSO4和Cu(OH)2的物质的量之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)a、b、c三种元素的原子半径由大到小的顺序是___(填元素符号);b、f、h三种元素对应简单氢化物的热稳定性由强到弱的顺序是___(填化学式)。
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是___(填水化物的化学式)。
(3)利用如图装置可比较a、e、h的非金属性强弱,则装置中试剂X、Z分别为___(填化学式)。
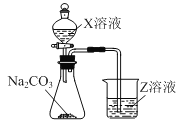
(4)元素i的原子结构示意图为___;写出元素i的最高价氧化物对应水化物溶液与元素d的单质反应的离子方程式___。
(5)推测原子序数为34的元素在周期表中的位置___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L0.01 molL-1H2B溶液中滴加盐酸或NaOH溶液,溶液中 c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+) 的对数值(lgc)与pH的关系如图所示(温度保持不变),下列说法错误的是
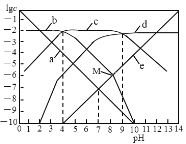
A.曲线c表示lgc(HB-)与pH的关系
B.随pH增加,c(H2B)c(OH-)增大
C.0.01 molL-1Na2B溶液,Kh1(B2-)的数量级为10-9
D.M点溶液中n(Na+)+n(H+)―n(B2-)=0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( )
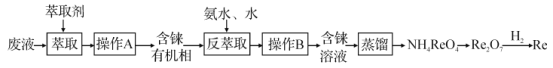
A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4-
B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用
C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re
D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com