
【题目】下列反应中必须加入还原剂才能进行的是( )
A. Fe3+→Fe2+B. Zn→ Zn2+C. H2→H2OD. CuO→CuCl2
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】通过对近代化学发展的里程碑的学习,我们体会到化学是在原子、分子水平上研究物质的自然科学,请把重大成果与发现者连起来_____。
①道尔顿 a.提出化学元素的概念
②波义耳 b.建立氧化学说
③拉瓦锡 c.提出原子论
④门捷列夫 d.发现元素周期律
⑤阿伏加德罗 e.分子学说
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属腐蚀的电化学原理可用下图模拟。
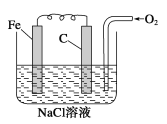
(1)请写出有关电极反应式:_________________________
①铁棒上的电极反应式:_______________________
碳棒上的电极反应式:_________________________
(2)该图所表示的是_________________________(填“析氢”或“吸氧”)腐蚀。
(3)若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示__________(填“析氢”或“吸氧”)腐蚀原理;若用牺牲阳极法来保护铁棒不被腐蚀溶解,即可将碳棒改为_________棒。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
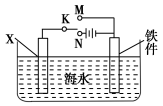
(2)利用上图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。
(4)上图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是 ,若将开关K置于N处,发生的总反应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中生成物的总能量大于反应物的总能量的是()
A.氢氧化钡晶体与氯化铵晶体混合B.铝热反应
C.木炭在氧气中发生不完全燃烧D.生石灰和水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自来水蒸馏实验中,下列操作叙述正确的是( )
A.在蒸馏烧瓶中盛满自来水,并放入几粒沸石
B.将温度计水银球插到蒸馏烧瓶自来水中
C.冷水从冷凝器上口入、下口出
D.收集冷凝水时,应弃去开始蒸馏出的部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25%氨水的密度为0.91g.cm-3,5%氨水的密度为0.98g.cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
A. 等于15% B. 大于15% C. 小于15% D. 无法估算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的是( ) 
A.可用图①所示装置收集SO2
B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱
C.可用图③所示装置除去CH4中混有的少量C2H4
D.可用图④所示装置防止铁钉生锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com