
下列离子方程式中,属于水解反应的是()
A. CH3COOH+H2O⇌CH3COO﹣+H3O+ B. CO2+H2O⇌HCO3﹣+H+
C. CO32﹣+H2O⇌HCO3﹣+OH﹣ D. HS﹣+H2O⇌S2﹣+H3O+
考点: 离子方程式的书写.
分析: 水解离子反应中弱酸或弱碱离子结合水电离生成的氢离子或氢氧根离子生成弱电解质,以此分析.
A.为乙酸的电离方程式;B.为碳酸的电离方程式;C.为碳酸根离子的水解方程式;D.为硫氢根离子方程式.
解答: 解:A.乙酸电离生成乙酸根离子和水合氢离子,则CH3COOH+H2O⇌CH3COO﹣+H3O+为电离方程式,水解反应为CH3COO﹣+H2O⇌CH3COOH+OH﹣,故A错误;
B.二氧化碳和水反应生成碳酸,碳酸不水解,电离出碳酸氢根离子和氢离子,故B错误;
C.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,故C正确;
D.硫氢根离子电离出硫离子和和水合氢离子,则HS﹣+H2O⇌S2﹣+H3O+,为电离方程式,水解反应为HS﹣+H2O⇌H2S+OH﹣,故D错误;
故选C.
点评: 本题考查水解的离子反应,明确水解的反应原理是解答本题的关键,注意区分水解、电离的离子反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,下列研究目的和示意图相符的是()
A B C D
研究目的 压强对反应的影响
(p2>p1) 温度对反应的影响 平衡体系增加O2的浓度对反应的影响 体积恒定的密闭容器中催化剂对反应的影响
图示 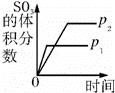
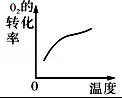
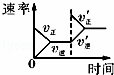

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B. 热化学方程式中,各物质前的化学计量数不表示分子个数
C. 在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)⇌C(g)+D(g)已达平衡的是()
A. 混合气体的压强 B. 混合气体的密度
C. 混合气体的分子数目 D. 混合气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol,
②H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ/mol,
O2(g)=H2O(g)△H=﹣241.8kJ/mol,
③C(g)+ O2(g)=CO (g)△H=﹣110.5KJ/moL,
O2(g)=CO (g)△H=﹣110.5KJ/moL,
④C(s)+O2(g)=CO2(g)△H=﹣393.5KJ/moL.回答下列各问:
(1)上述反应中属于放热反应的是
(2)C的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为 .
(4)CO的燃烧热为 ,表示CO燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是()
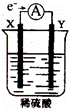
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 无色溶液中:K+、H+、Fe2+、NO3﹣
无色溶液中:K+、H+、Fe2+、NO3﹣
B. c(H+)<c(OH﹣)的溶液中:Na+、K+、SO42﹣、ClO﹣
C. 含0.1mol•L﹣1 HCO3﹣的溶液中:Al3+、Ca2+、NO3﹣、SO42﹣
D. 含0.1 mol•L﹣1 SCN﹣的溶液中:Fe3+、NH4+、NO3﹣、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
A. 水加热到很高的温度都难以分解
B. 水结冰成体积膨胀,密度减少
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D. HF、HCI、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原状况的是()
电解质溶液 阳极 阴极 加入的物质
A NaCl溶液 碳 铁 盐酸
B NaOH溶液 碳 碳 水
C 硫酸铜溶液 铜 碳 硫酸铜
D 硫酸 铁 碳 H2O
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com