
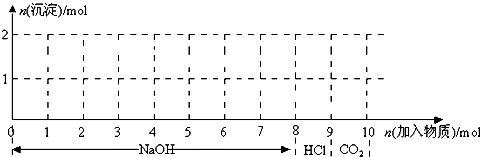
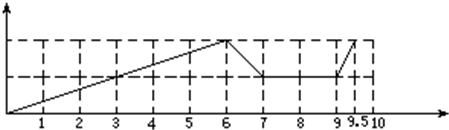

 ,
, ;
;

 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 .
.
| 3b |
| 4 |
| 3b |
| 4 |
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色退去,则说明含有Fe2+, 若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | Fe、Cu | Cu | Cu | - | - | - |
| 溶液中的金属离子 |
| 8 |
| 3 |
| x |
| 3 |
| 8 |
| 3 |
| x |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应条件 | 主要产物 | 生成1mol有机物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常压 | 甲烷(和水蒸气) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固态烷烃 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 异丁烷、异戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有机化合物 | |
| Rh原子簇配合物,高压液相 | 乙二醇 (少量乙酸、乙醇) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com