
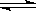 HB(n-1)-+OH-
HB(n-1)-+OH-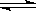 HB(n-1)-+OH-;(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:Ksp(HgS)<Ksp(FeS);FeS作为沉淀剂还可以起到净化水的作用,其原因为因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水;(5)因为Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15,c(B—)=1.6×10—3 mol·L-1,AB2、AC均为饱和的混合液,即c2(B—)c(A—)=4.2×10-8,所以c(A2+)=1.64×10—2mol·L-1,
HB(n-1)-+OH-;(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:Ksp(HgS)<Ksp(FeS);FeS作为沉淀剂还可以起到净化水的作用,其原因为因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水;(5)因为Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15,c(B—)=1.6×10—3 mol·L-1,AB2、AC均为饱和的混合液,即c2(B—)c(A—)=4.2×10-8,所以c(A2+)=1.64×10—2mol·L-1,

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)+C(H+)+C(NH4+)=C(SO42-)+C(OH-) |
| B.0.01 mol·L-1NaHCO3溶液中:C(Na+)>C(OH-)>C(HCO3-)>C(H+) |
| C.Na2CO3溶液中:C(OH-)= C(HCO3-)+2C(H2CO3)+ C(H+) |
| D.25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa溶液等体积混合,溶液呈酸性:C(Na+)>C(CH3COOH) >C(CH3COO-)>C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| B.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| C.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl④ NH3·H2O, c(NH4+)由大到小的顺序是:① > ③ > ② > ④ |
| B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-) |
| C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) =" c" (HCO3-) + c (H+) + c (H2CO3) |
| D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L- 1 的NaOH溶液等体积混合: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
| B.c(Na+)=2c(S2-)+c(OH-)+c(HS-) |
| C.向Na2S溶液中加水稀释,其所有离子的浓度都减小 |
| D.向溶液中加入少量NaOH固体,能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将纯水加热至较高温度,Kw变大、pH变小、呈酸性 |
| B.保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 |
| C.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
D.向0.1 mol·L-1氨水中加入少量水,pH减小, 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
)>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+) )>c(B-)>c(A-)>c(H+) D. c(
)>c(B-)>c(A-)>c(H+) D. c( )>c(HB)>c(HA)>c(H+)
)>c(HB)>c(HA)>c(H+)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com