
A、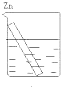 |
B、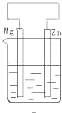 |
C、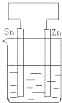 |
D、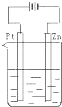 |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
| 物质 | 熔点 | 沸点 | 密度 | 水中溶解性 |
| 甲 | -98℃ | 57.7℃ | 0.93g?cm-3 | 可溶 |
| 乙 | -84℃ | 97℃ | 0.90g?cm-3 | 可溶 |
| A、萃取法 | B、过滤法 |
| C、蒸馏法 | D、分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气通过灼热的CuO粉末 |
| B、二氧化碳通过Na2O2粉末 |
| C、将锌粒投入Cu(NO3)2溶液 |
| D、碳酸氢钠固体加热至没有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于两支试管中 | ′ |
| 步骤2: | 若有 |
| 步骤3: | 若有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使淀粉碘化钾试纸变蓝的溶液中:K+、Ba2+、S2-、Cl- | ||
| B、FeCl3溶液中:K+、Na+、SO42-、AlO2- | ||
C、常温下,
| ||
| D、常温下由水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )| A、常温常压下,L是一种液态有机物 |
| B、E的二溴代物只有一种结构 |
| C、G具有强氧化性和漂白性 |
| D、上述反应的类型是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物的化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的最外层电子数与电子层数相同 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1mol甲与足量的乙完全反应共转移了1mol电子 |
| D、1.0L0.1mol?L-1戊溶液中阴离子总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com