
 已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )| A、常温常压下,L是一种液态有机物 |
| B、E的二溴代物只有一种结构 |
| C、G具有强氧化性和漂白性 |
| D、上述反应的类型是加成反应 |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
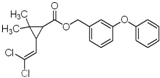
| A、分子式为C21H20Cl2O3 |
| B、不能使溴水褪色 |
| C、1mol氯菊酯与氢气加成最多消耗8 mol H2 |
| D、与NaOH溶液反应最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol |
| B、0.04mol |
| C、0.06mol |
| D、0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、Cl2O |
| C、Cl2O3 |
| D、ClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
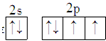 ,它的单质常温时为气态.试用化学符号回答以下问题.
,它的单质常温时为气态.试用化学符号回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10g | B、11.8g |
| C、13.2g | D、无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com