
|
已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol.现有H2和CO组成的混合气体56.0 L(标准状况),经充分燃烧后,放出的总热量为710.0 kJ,并生成液态水.下列说法正确的是 | |
| [ ] | |
A. |
CO燃烧的热化学方程式为:2CO(g)+O2(g) |
B. |
H2燃烧的热化学方程式为:2H2(g)+O2(g) |
C. |
燃烧前混合气体中,H2的体积分数为40% |
D. |
燃烧后的混合气体与足量的过氧化钠反应,转移电子的物质的量为2 mol |
科目:高中化学 来源: 题型:阅读理解



| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO燃烧的热化学方程式为:2CO(g)+O2(g)═2CO2(g)△H=+282.8 kJ/mol | B、H2燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | C、燃烧前混合气体中,H2的体积分数为40% | D、燃烧后的混合气体与足量的过氧化钠反应,转移电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mL pH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。
②下列有关Y的叙述正确的是__________
A.Y溶于水后部分发生电离
B.Y的水溶液中滴加石蕊试液会变红
C.稀释后溶液中所有离子的浓度均减小
D.稀释后,阴离子的物质的量浓度之和不变
③一定量X溶液和一定量的Y的溶液混合,所得溶液中离子浓度的等式关系为:
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2 的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________
查看答案和解析>>
科目:高中化学 来源:2013届云南省高二下学期期末考试化学试卷(解析版) 题型:填空题
(14分)某课外活动小组同学用图一装置进行实验,试回答下列问题。
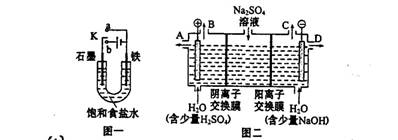
(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的 腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式 。
(2)芒硝(化学式为Na2SO4·10H2O),无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法。用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率来看都更加符合绿色化学理念。
① 该电解槽的阳极反应式为: ,此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”) 导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为 。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有 kJ的能量转化为电能。
查看答案和解析>>
科目:高中化学 来源:2010届河北沙河一中考前热身理综化学卷(二) 题型:实验题
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;

②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mL pH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。
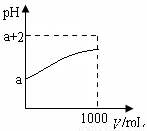
②下列有关Y的叙述正确的是__________
A.Y溶于水后部分发生电离
B.Y的水溶液中滴加石蕊试液会变红
C.稀释后溶液中所有离子的浓度均减小
D.稀释后,阴离子的物质的量浓度之和不变
③一定量X溶液和一定量的Y的溶液混合,所得溶液中离子浓度的等式关系为:
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2 的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com