
| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
分析 根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,据此分析解答.
解答 解:根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,
A.铁作负极,铜作正极,电解质为可溶性的氯化铁,则符合题意,故A不选;
B.铁作负极,碳作正极,电解质为可溶性的硝酸铁,则不符合题意,故B选;
C.铁作负极,银作正极,电解质为可溶性的铁盐,则符合题意,故C不选;
D.负极为Fe,正极为Pt,电解质为Fe2(SO4)3溶液,则符合题意,故D不选.
故选B.
点评 本题考查了原电池中正负极及电解质溶液的判断,根据得失电子判断正负极及电解质,难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 负极发生的反应为Fe-2e-=Fe3+ | |
| B. | 正极发生的反应为2H2O+O2+4e-=4OH- | |
| C. | Cl-向负极迁移 | |
| D. | 铁锈是Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0l mol•L-1•s-1 | B. | 0.002 mol•L-1•s-1 | ||
| C. | 0.06mol•L-•1s-1 | D. | 0.0025mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性减弱 | |
| B. | 放电时,电子由Zn经导线转移到K2FeO4 | |
| C. | 放电时每转移3mol电子,正极有1mol K2FeO4被还原 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
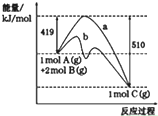
| A. | 曲线b表示使用催化剂后的能量变化 | |
| B. | 正反应活化能大于逆反应活化能 | |
| C. | 由图可知该反应的焓变△H=+91 kJ•mol-1 | |
| D. | 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 0.1 mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HS${o}_{3}^{-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
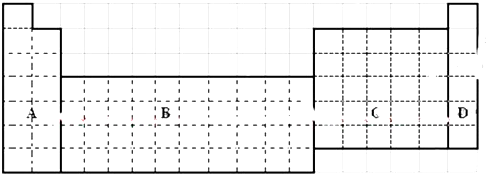
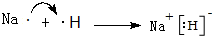 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com