
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液,量取10.00mL食用白醋,注入烧杯中用水稀释后转移到_____(填仪器名称)中定容,摇匀即得;
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂;
(3)读取盛装0.1000mol/L NaOH溶液的______(填仪器名称)的初始读数,如果液面位置如下图所示,则此时的读数为______mL。
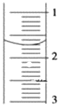
(4)滴定,当__________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(5)经计算,市售白醋总酸量=_______g/100mL (醋酸的式量=60)。
(6)在本实验过程中,下列操作会使实验结果偏大的是______(填写序号)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定剧烈摇动,有少量液体溅出
【答案】100mL容量瓶 酚酞 碱式滴定管 0.70 溶液由无色变为浅红色,并在半分钟内不褪色 4.5 A B
【解析】
(1)溶液的稀释在烧杯中进行,溶液的定容在对应体积的容量瓶中进行;
(2)根据强碱滴定弱酸应选择碱性变色范围内的指示剂;
(3)根据碱溶液应盛放在碱式滴定管中;根据滴定管的结构与精确度来读取;
(4)滴定结束前溶液为无色,滴定结束时溶液变为浅红色,据此判断滴定终点;
(5)根据数据的合理性求出平均消耗的NaOH溶液的体积,然后根据白醋与NaOH溶液反应的关系式来解答;
(6)根据c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
I.(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液,故答案为:100mL容量瓶;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,故答案为:酚酞;
(3)NaOH溶液应盛放在碱式滴定管中;滴定管液面的读数0.70mL,故答案为:碱式滴定管;0.70;
(4)酚酞遇到酸不显色,在弱碱溶液中显浅红色,则滴定终点时溶液从无色变为浅红色,所以滴定终点的现象为溶液由无色变为浅红色,并在半分钟内不褪色,故答案为:溶液由无色变为浅红色,并在半分钟内不褪色;
(5)第1次滴定误差明显较大,应舍去,其他3次消耗的NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有CH3COOOHxg,则
CH3COOOH~~~~~NaOH
60 40
xg×0.20.1000mol/L×0.015L×40g/mol
![]() =
=![]() ,解得:x=0.450,样品总酸量为
,解得:x=0.450,样品总酸量为![]() =4.5g/100mL,故答案为:4.5;
=4.5g/100mL,故答案为:4.5;
(6)A.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=![]() 分析,可知c(待测)偏大,故A正确;B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析,可知c(待测)偏大,故A正确;B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析,可知c(待测)偏大,故B正确;C.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=
分析,可知c(待测)偏大,故B正确;C.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=![]() 分析,可知c(待测)无影响,故C错误;D.锥形瓶在滴定时距离摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=
分析,可知c(待测)无影响,故C错误;D.锥形瓶在滴定时距离摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=![]() 分析,可知c(待测)偏小,故D正确;故选AB。
分析,可知c(待测)偏小,故D正确;故选AB。


科目:高中化学 来源: 题型:
【题目】氯喹(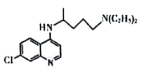 )对治疗新冠病毒肺炎有明确疗效,氯喹的合成方法如下。
)对治疗新冠病毒肺炎有明确疗效,氯喹的合成方法如下。
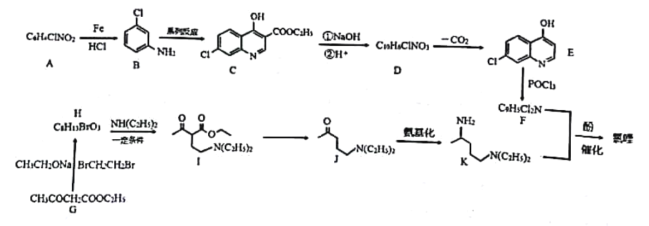
回答下列问题
(1)A中所含官能团的名称是_______________;
(2)写出G到H的反应类型_______________;
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。B与足量氢气反应生成物X,写出X的结构简式.并用星号(*)标出X中的手性碳__________________;
(4)写出C到D过程中①的反应方程式________________________;
(5)写出具有醛基、羧基、核磁共振氢谱只有四组峰的G的同分异构体所有的结构简式(不考虑立体异构)__________________________。
(6)参考以上合成路线,设计由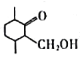 、1一溴丙烷为原料合成
、1一溴丙烷为原料合成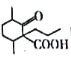 的合成路线_________________________(无机试剂与含两个碳的有机物任选)。
的合成路线_________________________(无机试剂与含两个碳的有机物任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A. 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
B. 用量筒量取上述盐酸
C. 若选用酚酞作指示剂,终点时,液体恰好褪色
D. 盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式书写正确的是
A.向氯化铁溶液中加入铁粉,颜色变浅:2Fe3++Fe=3Fe2+
B.向碳酸氢钠溶液中滴加稀盐酸,产生气体:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向稀硝酸溶液加入少量锌粉:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中滴加稀硫酸,生成沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是( )
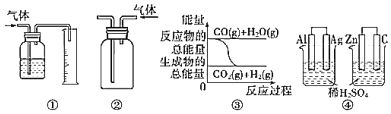
A.用图①所示装置测量气体的体积
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备直径为1-100nm的颗粒Y(化合物),反应原理为3Fe2++2![]() +O2+aOH-=Y+
+O2+aOH-=Y+![]() +2H2O,下列说法中不正确的
+2H2O,下列说法中不正确的
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.Fe2+、![]() 都是还原剂
都是还原剂
D.每有3molFe2+参加反应,反应中转移的电子总数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图:
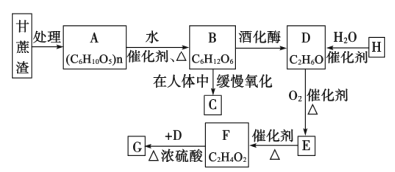
已知:石油裂解已成为生产H的主要方法,G是具有香味的液体。回答下列问题:
(1)H中的官能团名称为____________;E的名称为____________。
(2)H→D的化学反应类型为____________。
(3)实验室中制备G的反应装置如图所示:
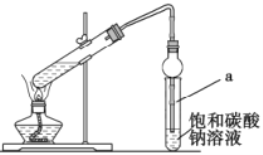
①与教材中采用的实验装置不同,此装置中采用了球形干燥管,其作用是____________。饱和碳酸钠溶液的作用____________。
②实验结束后,若要分离试管a中的G需要用到的主要玻璃仪器是____________、烧杯。
③若实验中用含18O的D与F反应则F→G的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
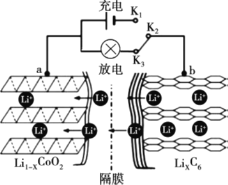
① 放电时,电子的流动方向为______。(用a、b、K2、K3)
② 放电时,正极的电极反应式为______。
(2)钴酸锂回收再生流程如下:
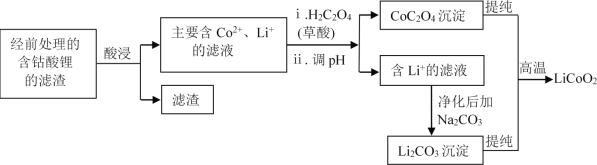
① 用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
② 用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸。主要原因是:
ⅰ.会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
ⅱ.Cl-对建筑材料的腐蚀及带来的水体问题等。
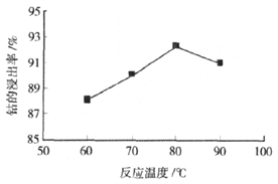
③ 其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释随着温度升高,钴的浸出率先升高后降低的原因:______。
④ 已知草酸为二元弱酸,应用化学平衡移动原理,结合化学用语解释CoC2O4沉淀的同时溶液酸性增强的原因:______。
⑤ 高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com