
【题目】下列解释事实的离子方程式书写正确的是
A.向氯化铁溶液中加入铁粉,颜色变浅:2Fe3++Fe=3Fe2+
B.向碳酸氢钠溶液中滴加稀盐酸,产生气体:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向稀硝酸溶液加入少量锌粉:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中滴加稀硫酸,生成沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
科目:高中化学 来源: 题型:
【题目】某化学小组为研究SO2的化学性质并探究与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持,加热装置已略,气密性已检验)

实验操作和现象如下:
(1)关闭活塞K2,K3,打开活塞K1,向A中滴加一定量的浓硫酸并加热,A中有白雾生成,铜片表面产生气泡。
(2)当C出现明显现象后,关闭K1,并停止加热。
①写出A中发生反应的化学反应方程式______;
②B装置的作用是_____;
③C中的现象为__;
(3)打开活塞K2,再向A中滴加一定量的浓硫酸并加热,D中有气泡冒出,产生少量白色沉淀,E中产生白色沉淀,液面上方略显浅棕色并逐渐消失;
(4)从D、E中分别取少量白色沉淀,加稀盐酸,白色沉淀不溶解。
①分析D中产生不溶于稀盐酸的沉淀的原因____;
②为了证实上述分析是否正确,在原实验基础上,在打开活塞K2之后增加一步操作,该操作是___;
(5)增加以上操作后,重复实验步骤(3),D中无沉淀生成,而E中仍产生白色沉淀,用离子方程式解释E中仍有白色沉淀的原因__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
选项 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br>I |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A的产量是衡量一个国家石油化工发展水平的标志。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示:
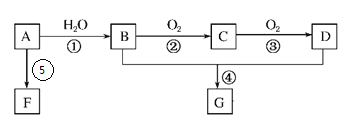
已知:![]()
(1)A分子的结构简式为_____________;B中官能团名称为_____________。
(2)在反应①~⑤中,属于加成反应的是______,属于取代反应的是______(填序号)。
(3)写出下列反应的化学方程式:
④B+D→G:_______________________;
⑥A→F:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分Fe3O4,Fe2O3,FeO和部分难溶于酸的杂质)制备绿矾(FeSO47H2O)的流程如下:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为____________(填名称)。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、____________。
(3)检验②中Fe3+已经完全转化为Fe2+实验方法:取适量溶液2,____________。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到平衡,用CO2表示该反应的平均速率ν(CO2)=________mol/(Lmin);
(2)平衡时氢气的物质的量浓度为_______mol/L;
(3)该条件下该反应的平衡常数K=_______;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_______;
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,平衡将_______(填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液,量取10.00mL食用白醋,注入烧杯中用水稀释后转移到_____(填仪器名称)中定容,摇匀即得;
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂;
(3)读取盛装0.1000mol/L NaOH溶液的______(填仪器名称)的初始读数,如果液面位置如下图所示,则此时的读数为______mL。
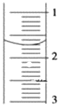
(4)滴定,当__________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(5)经计算,市售白醋总酸量=_______g/100mL (醋酸的式量=60)。
(6)在本实验过程中,下列操作会使实验结果偏大的是______(填写序号)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。

(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com