
【题目】由硫铁矿“烧渣”(主要成分Fe3O4,Fe2O3,FeO和部分难溶于酸的杂质)制备绿矾(FeSO47H2O)的流程如下:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为____________(填名称)。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、____________。
(3)检验②中Fe3+已经完全转化为Fe2+实验方法:取适量溶液2,____________。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、____________、洗涤、干燥。
【答案】硫酸 Fe2O3+6H+=2Fe3++3H2O 向其中滴加KSCN溶液,溶液不变红 过滤
【解析】
烧渣(主要成分:Fe3O4、Fe2O3和FeO)均溶于硫酸,溶液1含Fe2+、Fe3+,步骤②发生FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,步骤③为蒸发浓缩、冷却结晶析出绿矾,以此解答该题。
(1)因绿矾的酸根离子为硫酸根离子,则步骤①,应用硫酸来溶解烧渣;
(2)①中生成Fe3+的物质有Fe3O4、Fe2O3,则另一个离子反应为Fe2O3+6H+=2Fe3++3H2O;
(3)可向其中加入KSCN溶液,溶液不变红,则可说明②中Fe3+已经完全转化为Fe2+;
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】有一种化合物结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y是同周期元素,Z的含氧酸均具有氧化性,该化合物相对分子质量小于125。下列有关说法正确的是
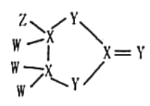
A.WZ沸点高于W2Y的沸点
B.X的含氧酸一定为二元弱酸
C.原子半径大小:Z>Y>X>W
D.X与Z组成的化合物中可能含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E原子序数依次增大。A元素原子半径小于B,元素A、 E同主族。B是组成有机物的必要元素,C元素最高价氧化物对应水化物X与其氢化物Y反应生成一种盐。D元素的原子最外层电子数是其电子层数的3倍。
(1) E元素在周期表中的位置是__________; X和Y形成的化合物的化学式为___________;
(2)A、D两元素形成的原子个数比为1: 1的化合物的电子式为____________;
(3) Y的水溶液与氯化镁溶液反应的离子方程式为______________;
(4)元素B的单质能在加热条件下与浓硫酸反应,产物中含有两种气体物质,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A. 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
B. 用量筒量取上述盐酸
C. 若选用酚酞作指示剂,终点时,液体恰好褪色
D. 盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式书写正确的是
A.向氯化铁溶液中加入铁粉,颜色变浅:2Fe3++Fe=3Fe2+
B.向碳酸氢钠溶液中滴加稀盐酸,产生气体:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向稀硝酸溶液加入少量锌粉:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中滴加稀硫酸,生成沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是( )
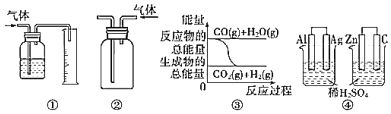
A.用图①所示装置测量气体的体积
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图:
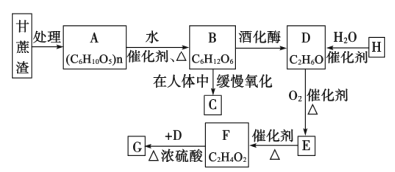
已知:石油裂解已成为生产H的主要方法,G是具有香味的液体。回答下列问题:
(1)H中的官能团名称为____________;E的名称为____________。
(2)H→D的化学反应类型为____________。
(3)实验室中制备G的反应装置如图所示:
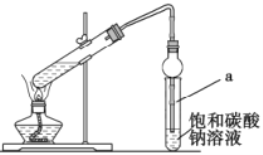
①与教材中采用的实验装置不同,此装置中采用了球形干燥管,其作用是____________。饱和碳酸钠溶液的作用____________。
②实验结束后,若要分离试管a中的G需要用到的主要玻璃仪器是____________、烧杯。
③若实验中用含18O的D与F反应则F→G的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法不正确的是

A. HX为弱酸
B. V1 <20
C. M点溶液中离子浓度由大到小的顺序为:c(X-)>c(Na+)>c(H+)>c(OH-)
D. 二者等体积混合时,c(Na+)=c(X-) + c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com