
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到平衡,用CO2表示该反应的平均速率ν(CO2)=________mol/(Lmin);
(2)平衡时氢气的物质的量浓度为_______mol/L;
(3)该条件下该反应的平衡常数K=_______;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_______;
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,平衡将_______(填“正向”、“逆向”或“不移动”)。
【答案】0.075 0.75 ![]() CD 逆向
CD 逆向
【解析】
根据v= ![]() 计算(1);根据三段式分析解答(2)(3);
计算(1);根据三段式分析解答(2)(3);
(4)要使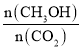 增大,应使平衡向正反应方向移动;
增大,应使平衡向正反应方向移动;
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,体积增大,平衡向气体体积增大的方向进行,据此分析判断。
(1)根据图像,二氧化碳浓度减小了0.75mol/L,则v(CO2)=![]() =0.075mol/(Lmin),故答案为:0.075;
=0.075mol/(Lmin),故答案为:0.075;
(2) CO2(g)+3H2(g)CH3OH(g)+H2O(g),
开始(mol/L): 1 3 0 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.750.750.75
氢气的平衡浓度为0.75mol/L,故答案为:0.75;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)要使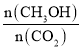 增大,应使平衡向正反应方向移动。A.因正反应放热,升高温度平衡向逆反应方向移动,则
增大,应使平衡向正反应方向移动。A.因正反应放热,升高温度平衡向逆反应方向移动,则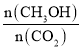 减小,故A错误;B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,
减小,故A错误;B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,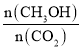 不变,故B错误;C.将H2O(g)从体系中分离,平衡向正反应方法移动,
不变,故B错误;C.将H2O(g)从体系中分离,平衡向正反应方法移动,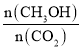 增大,故C正确;D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则
增大,故C正确;D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则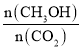 增大,故D正确;故答案为:CD;
增大,故D正确;故答案为:CD;
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,体积增大,平衡向气体体积增大的方向进行,CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡逆向进行,故答案为:逆向。


科目:高中化学 来源: 题型:
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向Ba(AlO2)2溶液中加入过量NaHSO4溶液:Ba2++SO42-=BaSO4↓
B.泡沫灭火器中Al(SO4)3和NaHCO3溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C.以铜为电极,电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.向Cu(OH)2浊液中滴加饱和FeCl3溶液产生红褐色沉淀:Cu(OH)2+Fe3+Fe(OH)3+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铁、镍及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态铁原子的外围电子排布式为__________。
(2)NaBH4、LiBH4常作有机合成的还原剂。LiBH4中B原子的杂化方式为________;BH4-的空间构型为____________。
(3)NiO、FeO的晶体类型相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm。熔点:FeO_____NiO(填“>”、“<”或“=”),理由是____________。
(4)镍能形成多种配合物,如Ni(CO)4、[Ni(NH3)6]2+等。[Ni(NH3)6]2+中,Ni2+的配位数为_________;在Ni(CO)4中提供孤电子对的原子是C,不是O,可能的原因是_________。
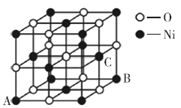
(5)氧化镍晶胞如图所示,镍离子的配位数为__________。已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为__________g·cm-3。
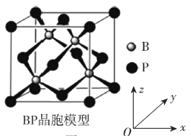
(6)磷化硼晶体结构类似金刚石,是一种耐磨材料,常作金属涂层,其晶胞如图所示。磷化硼晶胞沿z轴的平面投影图中,B原子构成的几何形状是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式书写正确的是
A.向氯化铁溶液中加入铁粉,颜色变浅:2Fe3++Fe=3Fe2+
B.向碳酸氢钠溶液中滴加稀盐酸,产生气体:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向稀硝酸溶液加入少量锌粉:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中滴加稀硫酸,生成沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.15g甲基(-CH3)中含有的电子数为9NA
B.标准状况下,2.24L辛烷中所含碳原子数为0.8NA
C.1.8gH2O与D2O的混合物中含有的质子数和电子数均为NA
D.—定条件下,密闭容器中2molSO2(g)与1molO2(g)充分反应,则容器中分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备直径为1-100nm的颗粒Y(化合物),反应原理为3Fe2++2![]() +O2+aOH-=Y+
+O2+aOH-=Y+![]() +2H2O,下列说法中不正确的
+2H2O,下列说法中不正确的
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.Fe2+、![]() 都是还原剂
都是还原剂
D.每有3molFe2+参加反应,反应中转移的电子总数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
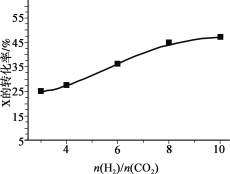
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com