
【题目】下列离子方程式书写正确的是
A.向Ba(AlO2)2溶液中加入过量NaHSO4溶液:Ba2++SO42-=BaSO4↓
B.泡沫灭火器中Al(SO4)3和NaHCO3溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C.以铜为电极,电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.向Cu(OH)2浊液中滴加饱和FeCl3溶液产生红褐色沉淀:Cu(OH)2+Fe3+Fe(OH)3+Cu2+
【答案】B
【解析】
A. 向Ba(AlO2)2溶液中加入过量NaHSO4溶液,发生离子反应Ba2++2AlO2-+SO42-+8H+=BaSO4↓+2Al3++4H2O,A错误;
B. NaHCO3与Al2(SO4)3发生相互促进的水解反应生成二氧化碳和氢氧化铝,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,B正确;
C.用铜作电极电解CuSO4溶液,阳极铜优先放电,阴极铜离子得到电子生成铜,该反应相当于电解精炼铜,C错误;
D.向Cu(OH)2浊液中滴加饱和FeCl3溶液产生红褐色沉淀,离子方程式为3Cu(OH)2+2Fe3+2Fe(OH)3+3Cu2+,D错误;
答案选B。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A.1mol铁在1molCl2中燃烧,最终转移的电子数为2NA
B.50g质量分数为46%的乙醇水溶液中含有的氢原子总数为6NA
C.1mol雄黄(主要成分为As4S4,结构为 中含有8NA个S-As键
中含有8NA个S-As键
D.标准状况下,22.4LCHCl3中含有氯原子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
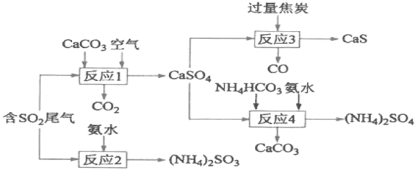
(1)反应1的化学方程式为________________;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________;
(4)整个合成路线中可以循环利用的物质是_____________;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
选项 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br>I |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂离子电池,放电时电池反应为2Li+MgH2=Mg+2LiH,装置如图所示。下列说法不正确的是:
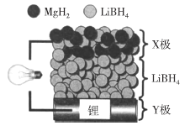
A.放电时,化学能只转化为电能B.放电时,X极的反应式为MgH2+2e-=Mg+2H-
C.充电时,Li+向Y极迁移D.充电时,理论上转移0.2NA个电子Y极增重1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A的产量是衡量一个国家石油化工发展水平的标志。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示:
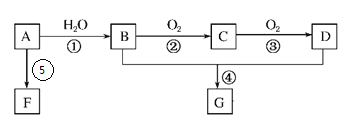
已知:![]()
(1)A分子的结构简式为_____________;B中官能团名称为_____________。
(2)在反应①~⑤中,属于加成反应的是______,属于取代反应的是______(填序号)。
(3)写出下列反应的化学方程式:
④B+D→G:_______________________;
⑥A→F:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到平衡,用CO2表示该反应的平均速率ν(CO2)=________mol/(Lmin);
(2)平衡时氢气的物质的量浓度为_______mol/L;
(3)该条件下该反应的平衡常数K=_______;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_______;
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,平衡将_______(填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用离子方程式CO![]() +2H+=CO2↑+H2O表示的是
+2H+=CO2↑+H2O表示的是
①Na2CO3+2HCl=2NaCl+CO2↑+H2O ②K2CO3+H2SO4=K2SO4+CO2↑+H2O
③CaCO3+2HCl=CaCl2+CO2↑+H2O ④2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
A.①②B.①②③C.①③④D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com