
【题目】以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
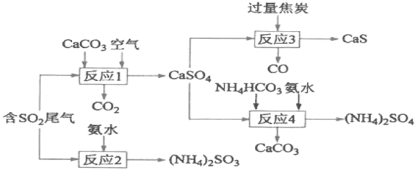
(1)反应1的化学方程式为________________;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________;
(4)整个合成路线中可以循环利用的物质是_____________;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________。
【答案】2CaCO3+O2+2SO2===2CaSO4+2CO2 2NH3H2O+SO2==![]() +
+![]() +H2O CO-2e-+
+H2O CO-2e-+![]() ===2CO2 CaCO3 448L
===2CO2 CaCO3 448L
【解析】
反应1中二氧化硫与碳酸钙、空气中的氧气反应生成硫酸钙,硫元素化合价发生变化,故发生氧化还原反应;反应2中二氧化硫与一水合氨反应生成亚硫酸铵;反应3中硫酸钙与过量焦炭发生氧化还原反应生成硫化钙和一氧化碳,反应方程式为CaSO4+4C=CaS+4CO↑;反应4中硫酸钙与碳酸氢铵、氨水反应生成硫酸铵和碳酸钙,反应方程式为CaSO4+NH4HCO3+NH3![]() H2O=CaCO3+(NH4)2SO4。
H2O=CaCO3+(NH4)2SO4。
(1)反应1中碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2。
(2)反应2中用足量氨水吸收SO2,反应生成亚硫酸铵,故该反应的离子方程式为2NH3H2O+SO2==![]() +
+![]() +H2O。
+H2O。
(3)燃料电池中CO通入负极发生氧化反应,碳元素失电子,化合价升高生成碳酸根离子,则负极电极反应式为CO-2e-+![]() ===2CO2。
===2CO2。
(4)反应1中碳酸钙作为反应物,而反应4中又生成碳酸钙,故碳酸钙可以循环利用。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,故一氧化氮与亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为2(NH4)2SO3+2NO=2(NH4)2SO4+N2,10.00L 2.00mol/L的(NH4)2SO3溶液中,n[(NH4)2SO3]= 10.00L![]() 2.00mol/L=20mol,n[(NH4)2SO3]:n(NO)=1:1,则n(NO)=20mol,则标准状况下NO气体的体积V=20mol
2.00mol/L=20mol,n[(NH4)2SO3]:n(NO)=1:1,则n(NO)=20mol,则标准状况下NO气体的体积V=20mol![]() 22.4L/mol=448L。
22.4L/mol=448L。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】根据所给的实验装置,下列有关实验的相关叙述正确的是
选项 | 实验装置 | 相关叙述 |
A |
| 实验室可以用该装置和药品制取氨气 |
B |
| 反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应 |
C |
| ①中反应比②中快,说明温度升高可以加快反应速率 |
D |
| 只有氨气等极易溶于水的气体才能利用该装置形成喷泉 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李比希是 19 世纪最著名和最有成果的化学家。他的贡献之一就是发明了燃烧法测定有机物化学组成。
Ⅰ.某物质完全燃烧后生成二氧化碳和水,现取 3.0g 该物质利用李比希法进行组成测定,无水氯化钙增重 1.8g,浓氢氧化钾溶液增重 4.4g,则该物质的最简式为_________________;
Ⅱ.多种物质符合此最简式,若要确定具体的物质,还需辅助其它的测量手段。
(1)若物质 A 的质谱图如图所示:
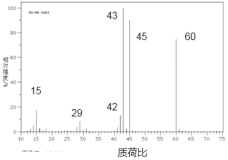
①则 A 的相对分子质量为_____________________;
②若将 A 加入到紫色石蕊试液中变红,则 A 的结构简式为________________;
(2)若测定物质 B 的蒸气密度是相同状况下 H2 的 45 倍
①则 B 的分子式为__________________;
②测定 B 的红外光谱图有 C=O 键、O—H 键、不对称—CH2—等的振动吸收峰,其核磁共振氢谱如图所示,B 的结构简式为_________________;

③取一定量的B物质平均分成2份,一份与足量的NaHCO3作用,一份与足量的Na作用,则产生的CO2与H2的体积比为___;
(3)若测定 C 物质的相对分子质量为 180,且 C 为淀粉水解的最终产物,并且在一定条件下, C 能与上述的 A 物质发生如下转化关系:

①请写出 D 变成 E 的化学方程式___________________;
②已知 G 物质为 D 物质的同系物,相对分子质量比 D 大 14,且其核磁共振H谱显示 3 组峰,面积比为 6:1:1,请写出 G 与 A 发生酯化反应的方程式____________,
Ⅲ.分别将等质量的上述A、B、C三种物质与足量的氧气反应,它们实际消耗氧气的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种用途广泛的常见氧化剂,主要用于化工、防腐及制药工业等。
I.某课外小组设计以锰酸钾制备高锰酸钾的方案如下:
i.锰酸钾的制备:
(1)将二氧化锰、氨酸钾和氢氧化钾固体放入______(填字母)中熔融制锰酸钾。
A.烧杯B.瓷坩埚C.蒸发皿D.铁坩埚
ii.高锰酸钾的制备(装置如图所示,加热及夹持装置省略):
将i中制得的锰酸钾加少量蒸馏水溶解,得墨绿色溶液,倒入三颈烧瓶中。打开甲装置中的分液漏斗活塞加入稀硫酸,加热,使生成的乙酸进入乙装置中并水浴加热。搅拌丙装置中的溶液,锰酸钾在酸性条件下反应生成高锰酸钾和二氧化锰。
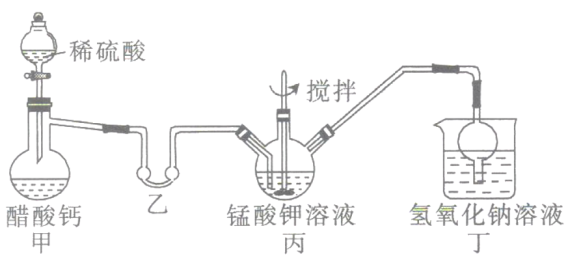
(2)检验该装置气密性的方法:连接好装置,_________________。
(3)乙装置的作用是___________;丁装置中NaOH溶液的作用是____________________。
(4)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,_______、______、抽滤,得到针状的高锰酸钾晶体。高锰酸钾晶体只能低温烘干,其原因为_____________________。
II.利用氧化还原滴定法测定高锰酸钾的纯度,发生反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
(5)量取一定体积的高锰酸钾溶液需使用滴定管_______(填字母)。

(6)若在实验过程中存在下列操作,会使所测KMnO4浓度偏高的是____(填字母)。
A锥形瓶用水洗之后末用待测液润洗
B.盛草酸溶液的滴定管滴定前尖嘴部分有气泡,滴定终点时无气泡
C.滴定时,草酸溶液洒落瓶外
D.盛装KMnO4溶液的滴定管用水洗后,未用KMnO4溶液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸利多卡因(F)可用于表面麻醉,还具有抗心律失常的作用,其合成路线:

回答下列问题:
(1)A的化学名称为______________,B→C的反应类型为____________。
(2)C→D的化学方程式为___________________。
(3)E中苯环上的一氯代物有___________种。
(4)X为B的芳香族同分异构体且苯环上仅有2个取代基,红外光谱显示X有氨基(-NH2),实验测得X能与NaHCO3溶液发生反应生成CO2,则X的结构可能有______种,其中一种核磁共振氢谱峰面积比为2:2:2:2:1的X的结构简式为______________________。
(5)已知工业上可用氯气催化乙酸生产氯乙酸,再以氯乙酸为原料,以S2Cl2、Cl2为氯化剂,加入适当的催化剂,即可制得氯乙酰氯(ClCH2COCl)。请设计以CH2=CH2为主要原料合成ClCH2COCl的路线流程图________________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向Ba(AlO2)2溶液中加入过量NaHSO4溶液:Ba2++SO42-=BaSO4↓
B.泡沫灭火器中Al(SO4)3和NaHCO3溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C.以铜为电极,电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.向Cu(OH)2浊液中滴加饱和FeCl3溶液产生红褐色沉淀:Cu(OH)2+Fe3+Fe(OH)3+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铁、镍及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态铁原子的外围电子排布式为__________。
(2)NaBH4、LiBH4常作有机合成的还原剂。LiBH4中B原子的杂化方式为________;BH4-的空间构型为____________。
(3)NiO、FeO的晶体类型相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm。熔点:FeO_____NiO(填“>”、“<”或“=”),理由是____________。
(4)镍能形成多种配合物,如Ni(CO)4、[Ni(NH3)6]2+等。[Ni(NH3)6]2+中,Ni2+的配位数为_________;在Ni(CO)4中提供孤电子对的原子是C,不是O,可能的原因是_________。
(5)氧化镍晶胞如图所示,镍离子的配位数为__________。已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为__________g·cm-3。
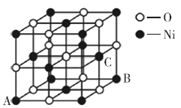
(6)磷化硼晶体结构类似金刚石,是一种耐磨材料,常作金属涂层,其晶胞如图所示。磷化硼晶胞沿z轴的平面投影图中,B原子构成的几何形状是__________。
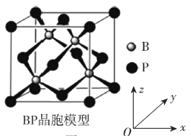
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com