
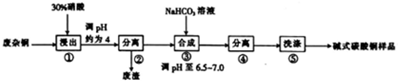
分析 用稀硝酸溶解废杂铜(主要成分为Cu,还含有少量杂质Fe),得到含有Cu2+、Fe3+的滤液,通过调节溶液pH为4左右,促进Fe3+的水解生成Fe(OH)3并利用过滤除去,在只含有Cu2+的溶液里,加入NaHCO3调节溶液pH至6.5~7.0,促进碱式碳酸铜的生成,并结合过滤、洗涤、干燥得到纯净的碱式碳酸铜;
(1)滴加稀硝酸的目的是溶解废杂铜中的金属铜和铁;
(2)浸出液中含有杂质离子Fe3+,利用促进Fe3+水解的方法使之转化为Fe(OH)3沉淀除去;
(3)NaHCO3溶液显碱性,投入Cu(NO3)2溶液速率慢易促进Cu2+水解生成Cu(OH)2,产物纯度降低,Cu(NO3)2和NaHCO3反应生成碱性碳酸铜、硝酸钠及CO2气体,可根据质量守恒和原子守恒写出此反应的方程式;
(4)固液分离的方法主要为过滤和离心分离机分离,其中离子机分离能减小产物的损失;
(5)反应后的混合液中主要含有Na+、NO3-,则沉淀的表面主要附着液中含有的离子也主要是Na+、NO3-;
(6)根据2Cu2+~I2~2SrO42-之间的关系式,利用消耗的标准液的物质的量计算Cu2+的物质的量,再计算铜元素的质量分数.
解答 解:用稀硝酸溶解废杂铜(主要成分为Cu,还含有少量杂质Fe),得到含有Cu2+、Fe3+的滤液,通过调节溶液pH为4左右,促进Fe3+的水解生成Fe(OH)3并利用过滤除去,在只含有Cu2+的溶液里,加入NaHCO3调节溶液pH至6.5~7.0,促进碱式碳酸铜的生成,并结合过滤、洗涤、干燥得到纯净的碱式碳酸铜;
(1)硝酸溶解废杂铜中的金属铜和铁时产生氮氧化物造成环境污染,且酸浸本身硝酸的利用率较低,故答案为:硝酸的利用率低,产生的氮氧化物也多;
(2)为促进Fe3+水解转化为Fe(OH)3沉淀除去,同时避免Cu2+水解生成Cu(OH)2,需要调整溶液pH调节在4左右,过虑得到的不溶物为Fe(OH)3,
故答案为:使Fe3+完全转化为沉淀、Cu2+不水解;Fe(OH)3;
(3)为防止Cu2+水解生成Cu(OH)2,影响产物纯度和产量,需要快速加入NaHCO3溶液,Cu(NO3)2和NaHCO3发生反应的化学方程式为2Cu(NO3)2+4NaHCO3=CuCO3•Cu(OH)2↓+4NaNO3+3CO2↑+H2O,故答案为:防止产生Cu(OH)2沉淀;2Cu(NO3)2+4NaHCO3=CuCO3•Cu(OH)2↓+4NaNO3+3CO2↑+H2O;
(4)固液分离时使用离心分离机分离比过滤操作效果好,能能减小产物的损失,故答案为:离心分离机;
(5)因滤液中含有Na+、NO3-,则沉淀洗涤的目的是除去附着液中含有的离子Na+、NO3-,故答案为:Na+、NO3-;
(6)根据关系式2Cu2+~I2~2SrO42-,消耗Na2SrO2的标准液的物质的量为:V×10-3L×cmol•L-1=1×10-3Vcmol,样品中Cu2+的物质的量为1×10-3Vcmol,则样品中铜元素的质量分数为:$\frac{64g/mol×1×1{0}^{-3}Vcmol}{mg}×100%$=$\frac{6.4cV}{m}%$,故答案为:$\frac{6.4cV}{m}%$.
点评 本题考查了实验探究物质分离方法和物质性质的分析判断,涉及离子反应、产物纯度的计算等,掌握物质性质是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 耐火陶瓷可以选用熔点很高的 Al2O3等材料制作 | |
| B. | 含量为 99.9999%的高纯硅用于制作光导纤维 | |
| C. | 高炉炼铁可用铝热反应来迚行冶炼 | |
| D. | “雷雨肥田“是因为 N2不O2在放电条件下生成氮的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
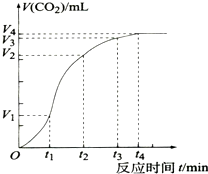 为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:
为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
A.Fe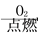 Fe2O3
Fe2O3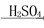 Fe2(SO4)3
Fe2(SO4)3
B.MgO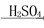 MgSO4(aq)
MgSO4(aq)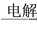 Mg
Mg
C.饱和NaCl(aq)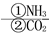 NaHCO3
NaHCO3 Na2CO3
Na2CO3
D.NH3 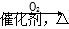 NO
NO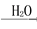 HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.NH4Cl的电子式: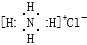
B.对硝基甲苯: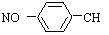
C.碳酸的电离方程式:H2CO3 2H++CO
2H++CO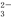
D.硫离子的结构示意图: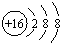
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苯酚钠溶液中通入少量的SO2气体:C6H5O-+SO2+H2O→C6H5OH+HSO3- | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈现中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com