
| A. | 向苯酚钠溶液中通入少量的SO2气体:C6H5O-+SO2+H2O→C6H5OH+HSO3- | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈现中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
分析 A.亚硫酸酸性强于苯酚,二者反应生成苯酚和亚硫酸钠;
B.二氧化碳过量,反应生成次氯酸和碳酸氢钙;
C.至中性,反应生成硫酸钡、硫酸钠和水,则二者以1:2反应,以此来解答;
D.用惰性电极电解MgCl2溶液,生成氢氧化镁、氢气、氯气.
解答 解:A.向苯酚钠溶液中通入少量的SO2:SO2+H2O+2C6H5O-→2C6H5OH+2SO32-,故A错误;
B.次氯酸钙溶液中通入过量二氧化碳,反应生成次氯酸和碳酸氢钙,离子方程式:ClO-+H2O+CO2═HCO3-+HClO,故B正确;
C.至中性,反应生成硫酸钡、硫酸钠和水,则二者以1:2反应,离子反应为2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,故C错误;
D.用惰性电极电解MgCl2溶液的离子反应为Mg2++2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+Cl2↑+H2↑,故D错误;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应、电解反应的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 按照系统命名法,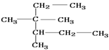 的名称为2,3-二甲基-2-乙基戊烷 的名称为2,3-二甲基-2-乙基戊烷 | |
| B. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| C. | 1mol 最多能与4mol氢氧化钠反应 最多能与4mol氢氧化钠反应 | |
| D. | 苯乙烯中所有原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
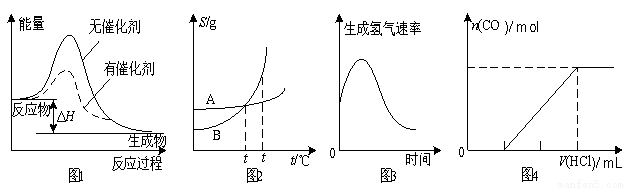
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了氧化还原反应 | |
| B. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 利用植物油的氧化反应可以获得人造脂肪 | |
| D. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存FeCl3溶液时,可加入少量NaOH,抑制Fe3+水解 | |
| B. | 1molMg在空气中完全燃烧生成MgO和少量Mg3N2,转移的电子数为2NA | |
| C. | 加入铝粉能产生H2的溶液中可以大量存在Fe2+、Na+、SO42-、ClO-四种离子 | |
| D. | 向硫酸氢铵溶液中滴加少量NaOH溶液时发生反应的离子方程式:H++NH4++20H-═NH3•HzO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的氯化铁溶液中:Na+、K+、Br-、SCN- | |
| B. | 水电离出的氢氧根离子浓度为10-13mol/L的溶液中:NH4+、K+、SiO32-、SO42? | |
| C. | 使酚酞试液变红色的溶液中:Na+、K+、HCO3-、S2? | |
| D. | 澄清透明的溶液中:K+、Ca2+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com