
����Ŀ��ij����ѧϰС����ճ������в���ȱ�ٵĵ�ζƷM����̽������֪C����D��ȼ�շ�����ɫ���森M���������ʵ�ת����ϵ��ͼ1��ʾ�����ֲ�������ȥ���� 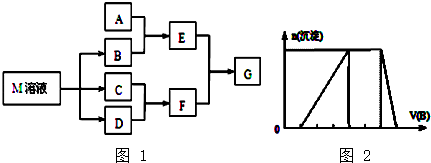
��1��д���ö��Ե缫���M��Һ�����ӷ���ʽ ��
��2����A��һ�ֳ���������������ҿ��������첣����E��Һ��F��Һ��Ӧ�����Ʊ�һ�ֽ��壬��E��Һ���׳��� ��
��3����A��һ�ֳ����������ʣ�������F��Һ��μ���E��Һ���ӱ�����������ʵ�������� ��
��4����A��һ�ֲ��ȶ����Σ�A��Һ��B��Һ��Ͻ�������ɫ��״������˲���Ϊ����ɫ������ɺ��ɫ��E����G��Һ�м��뱽����Һ������ɫ������Aת����E�����ӷ���ʽ ��
��5����A��һ�ֻ��ʣ�ʵ���ҿ���A��B��Ӧ��ȡ����E��E��F��E��D������ð���̣�������E��D�ķ�Ӧ��������D�Ĺܵ��Ƿ�й¶��д��E��D��Ӧ�Ļ�ѧ����ʽ�� ��
��6����A��һ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Fe3+��Al3+��CO32����SO42���е�ijЩ���ӣ��������Һ�м���B��Һʱ�������ɳ��������ʵ�����B��Һ����������仯��ͼ2��ʾ���ɴ˿�֪������Һ�г�H+��Al3+��϶����������ӣ�
���𰸡�
��1��2Cl��+2H2O ![]() 2OH��+H2��+Cl2��
2OH��+H2��+Cl2��
��2��ˮ����
��3����Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ
��4��4Fe2++8OH��+O2+2H2O=4Fe��OH��3��
��5��3Cl2+8NH3=N2+6NH4Cl
��6��NH4+��SO42
���������⣺��1.��C����D��ȼ�շ�����ɫ���棬Ϊ������������Ӧ����HCl������֪CΪH2��DΪCl2��FΪHCl��M���ճ������в���ȱ�ٵĵ�ζƷ����ת����ϵ��֪��M����Һ�������������������B������֪MΪNaCl��BΪNaOH���ö��Ե缫���M��Һ�����ӷ���ʽΪ��2Cl��+2H2O ![]() 2OH��+H2��+Cl2�������Դ��ǣ�2Cl��+2H2O
2OH��+H2��+Cl2�������Դ��ǣ�2Cl��+2H2O ![]() 2OH��+H2��+Cl2����
2OH��+H2��+Cl2����
��2.����A��һ�ֳ���������������ҿ��������첣������AΪSiO2 �� EΪNa2SiO3 �� ��F��Һ��Ӧ�����Ʊ�GΪH2SiO3 �� E����Һ�׳�ˮ���������Դ��ǣ�ˮ������
��3.����A��һ�ֳ����������ʣ�����NaOH��Һ�ܹ���Ӧ����AΪAl��EΪNaAlO2 �� ������HCl��Һ��μ���NaAlO2��Һ�У������������������������������ܽ⣬�ʿ���������Ϊ����Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ�����Դ��ǣ���Һ�����а�ɫ��״�������ɣ��Ҳ������ӣ�Ȼ�����ɶൽ�٣������ʧ��
��4.����A��һ�ֲ��ȶ����Σ�A��Һ��B��Һ��Ͻ�������ɫ��״������˲���Ϊ����ɫ������ɺ��ɫ��E������֪A�к���Fe2+ �� EΪFe��OH��3 �� GΪFeCl3 �� ����Aת����E�����ӷ���ʽ�ǣ�4Fe2++8OH��+O2+2H2O=4Fe��OH��3�������Դ��ǣ�4Fe2++8OH��+O2+2H2O=4Fe��OH��3����
��5.����A��һ�ֻ��ʣ�ʵ���ҿ���A��NaOH��Ӧ��ȡ����E����EΪNH3��AΪ��Σ�E������������ð���̣�������E�������ķ�Ӧ�������������Ĺܵ��Ƿ�й¶��������������Ӧ�����Ȼ�泥�ͬʱ���ɵ�������Ӧ����ʽΪ��3Cl2+8NH3=N2+6NH4Cl�����Դ��ǣ�3Cl2+8NH3=N2+6NH4Cl��
��6.����ͼ��֪����ʼ����NaOHû�г����������������һ����H+ �� һ��û��CO32�� �� �����г��������������ʧ����һ��û��Mg2+��Fe3+ �� һ������Al3+���м�γ������������䣬ӦΪNH4++OH��=NH3H2O�ķ�Ӧ������NH4+ �� �ɵ���غ��֪һ������SO42�� �� ���Դ��ǣ�NH4+��SO42 ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Т�MgSO4����Ba(NO3)2����NaOH����CuCl2������Һ�����������Լ����ɼ��������������Ⱥ�˳����(����)
A. �ۢܢڢ� B. �ۢܢ٢�
C. �ڢ٢ۢ� D. �ܢۢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƶ�˼ά�����ڻ�ѧѧϰ���о��г����������Ľ��ۣ�������ƵĽ�������Ҫ����ʵ���ļ������ȷ�����Ƿ���ȷ�����м������ƽ�������ȷ���ǣ� ��
A.��2Cu+O2 ![]() 2CuO���Ƴ�ͬ�����Ҳ��Cu+S
2CuO���Ƴ�ͬ�����Ҳ��Cu+S ![]() CuS
CuS
B.Fe3O4�ɱ�ʾΪFeO?Fe2O3 �� ��Pb3O4�ɱ�ʾΪPbO?Pb2O3
C.Na����ˮ��Ӧ����H2 �� K��CaҲ����ˮ��Ӧ����H2
D.CO2��Na2O2��Ӧֻ����Na2CO3��O2 �� ��SO2��Na2O2��Ӧֻ����Na2SO3��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ������ ��
A��HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ/mol��
��H2SO4��Ca(OH)2��Ӧ���к��ȡ�H=2��(-57��3)kJ/mol
B��CO�ı�ȼ�����ǡ�H=-283��0KJ/mol��
��ӦCO(g)+![]() O2(g)�TCO2(g)�ġ�H=��283��0KJ/mol
O2(g)�TCO2(g)�ġ�H=��283��0KJ/mol
C����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D��1 mol��ȼ��������̬�����������ų�����������Ƶ�ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.5molCl2�к������� ��
A. 0.5��Cl2 B. 1��Clԭ��
C. 3.01��1023��Clԭ�� D. 6.02��1023��Clԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ�����������ͭ�����ۼ���ϡ�����У����ȳ�ַ�Ӧ����������ʣ�ࡣ����Һ���ˣ���Һ�п��ܺ��е������� ( )
A.ϡ����B.�Ȼ�ͭC.�Ȼ���D.�Ȼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ��̶�Ϊ2L���ܱ������У�������Ӧ��aA��g��+bB��g��pC��g����H=������Ӧ�����¼�����
ʱ�䣨min�� | n��A����mol�� | n��B����mol�� | n��C����mol�� |
0 | 1 | 3 | 0 |
��2min | 0.8 | 2.6 | 0.4 |
��4min | 0.4 | 1.8 | 1.2 |
��6min | 0.4 | 1.8 | 1.2 |
��8min | 0.1 | 2.0 | 1.8 |
��9min | 0.05 | 1.9 | 0.3 |
����ݱ���������ϸ�������ش��������⣺
��1����2min����4min��A��ƽ����Ӧ����v��A��=molL��1min��1
��2���ɱ������ݿ�֪��Ӧ�ڵ�4min����6minʱ����ƽ��״̬�����ڵ�2min��6minʱ�ֱ�ı���ijһ����Ӧ��������ı�������ֱ�����ǣ��ٵ� 2min���ڵ� 6min��
��3����Ӧ�ڵ�4min����ƽ�⣬���¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ�� K= ��
��4���жϵ�9minʱ����/��ƽ�⣬˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����з���25.00mL������Һ����ƿ�У�
�ڽ���ʽ�ζ���������ˮϴ�����ñ���Һ��ϴ��������ע��0.1000mol/L�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶�����
������ƿ�е����̪��ָʾ�������еζ����ζ���ָʾ���պñ�ɫ���Ҳ������ϱ�ɫΪֹ�����������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ����5mL������ˮ�����������������ΪV2mL���Իش��������⣺
��1����ƿ�е���Һʱ���ﵽ�ζ��յ㣮
��2����С���ڲ�����еĴ�����
�ɴ���ɵIJⶨ�����ƫ�ߡ�ƫ�ͻ���Ӱ�죩
��3����ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����ΪMl 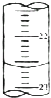
��4��������±����ݼ�������ռ���Һ��Ũ��mol/L��
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 4.00 | 24.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������ʩ�У���ͬʱ��߷�Ӧ���ʺͲ��ʵ���
A.�ϳɰ�ʹ�ø�ѹB.��������Pt-Rh�Ͻ�������
C.������ʱ�Ӵ���ʹ�ýϸ��¶�D.�����Ƽѭ������ĸҺ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com