
【题目】在0.5molCl2中含有( )
A. 0.5个Cl2 B. 1个Cl原子
C. 3.01×1023个Cl原子 D. 6.02×1023个Cl原子
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛NO,另一个盛N2和O2,在同温同压下,两容器内的气体一定具有相同的( )
A. 原子总数 B. 质子总数 C. 密度 D. 质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“西气东输”的气体是指天然气,主要成分是甲烷.工业上用碳与水在高温下反应制得水煤气.水煤气的主要成分是CO和H2 , 两者体积比约为1:1.1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成气态水放出242kJ热量;1molCH4气体完全燃烧生成CO2气体和气态水放出802kJ热量.
(1)写出H2完全燃烧生成气态水的热化学反应方程式:;
(2)忽略水煤气中其它成分,相同状况下若产生相等的热量,则所需水煤气体积是甲烷体积的倍,水煤气放出CO2的体积是甲烷放出CO2的体积的倍.
(3)以天然气代替水煤气作民用燃料,突出的优点是和 . (任写2点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在101 kPa时,足量H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为______,表示H2燃烧热的热化学方程式为___________________ 。
(2)1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为________,表示其中和热的热化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去): 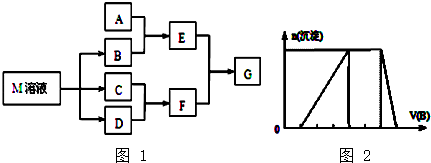
(1)写出用惰性电极电解M溶液的离子方程式 .
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 .
(3)若A是一种常见金属单质,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 .
(4)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式 .
(5)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .
(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中除H+和Al3+外肯定还含有离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
Ⅰ.制备碳酸亚铁:装置如图所示.
(1)装置B中可观察到的现象是铁粉逐渐溶解,
(2)将B中生成的FeCl2溶液压入装置C的操作是
(3)Ⅱ.制备乳酸亚铁:将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
加入少量铁粉的作用是
(4)从所得溶液中获得乳酸亚铁晶体所需的实验操作是、、洗涤、干燥.
(5)设计实验证明乳酸亚铁中含 Fe2+: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是 ,氧化产物是 。
②该反应中被氧化的物质与被还原的物质物质的量之比为 。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 ,还原剂是 。
②该反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是 L。
④请把各物质填在下面空格处,需配平:
______+□______![]() □______+□______+□______+□
□______+□______+□______+□
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com