
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
Ⅰ.制备碳酸亚铁:装置如图所示.
(1)装置B中可观察到的现象是铁粉逐渐溶解,
(2)将B中生成的FeCl2溶液压入装置C的操作是
(3)Ⅱ.制备乳酸亚铁:将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
加入少量铁粉的作用是
(4)从所得溶液中获得乳酸亚铁晶体所需的实验操作是、、洗涤、干燥.
(5)设计实验证明乳酸亚铁中含 Fe2+: .
【答案】
(1)液体中有气泡冒出、溶液变成浅绿色
(2)关闭活塞3,打开活塞2
(3)防止亚铁离子被氧化
(4)冷却结晶(或低温蒸发、冷却结晶);过滤
(5)取少量乳酸亚铁溶液于试管中,先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子
【解析】解:Ⅰ.(1.)装置B中铁粉与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,则观察到的现象为:铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色,所以答案是:液体中有气泡冒出、溶液变成浅绿色;
(2.)先关闭活塞3、打开活塞2,铁与稀盐酸反应生成的氢气使圆底烧瓶中压强增大,从而将B中生成的FeCl2溶液压入装置C,所以答案是:关闭活塞3,打开活塞2;
(3.)Ⅱ.制得的FeCO3在空气中容易被氧化成铁离子,所以要加少量的铁粉,防止亚铁离子被氧化,所以答案是:防止亚铁离子被氧化;
(4.)在75℃下搅拌使之充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作,所以答案是:冷却结晶(或低温蒸发、冷却结晶);过滤;
(5.)证明乳酸亚铁中含Fe2+的方法是:取少量乳酸亚铁溶液于试管中,先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子,所以答案是:取少量乳酸亚铁溶液于试管中,先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子.


科目:高中化学 来源: 题型:
【题目】有NO、CO2、N2O4三种气体,它们分别都含有0.5 mol氧原子,则三种气体的物质的量之比为( )
A. 1:2:4 B. 1:1:1 C. 4:2:1 D. 1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲醇的燃烧热数值为726.51kJmol﹣1 . 下列热化学方程式书写正确的是( )
A.CH4O+ ![]() O2═CO2+2H2O△H=﹣726.51 kJ?mol﹣1
O2═CO2+2H2O△H=﹣726.51 kJ?mol﹣1
B.CH4O(l)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ?mol﹣1
O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ?mol﹣1
C.2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ?mol﹣1
D.CH4O(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.51 kJ?mol﹣1
O2(g)═CO2(g)+2H2O(l)△H=﹣726.51 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5molCl2中含有( )
A. 0.5个Cl2 B. 1个Cl原子
C. 3.01×1023个Cl原子 D. 6.02×1023个Cl原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如图所示。

(1)下列有关生物质能的说法正确的是 。
a.生物质能本质上来源于太阳能
b.纤维素水解获得的产物中含有丰富的生物质能
c.生物质“热裂”获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,可作家庭燃气
(2)由生物质能可获得CO和H2。等物质的量的CO与H2反应时,其原子利用率可达100%,则该反应合成的物质可能是 。
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定为2L的密闭容器中,发生反应:aA(g)+bB(g)pC(g)△H=?,反应情况记录如表:
时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
0 | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=molL﹣1min﹣1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、6min时分别改变了某一个反应条件,则改变的条件分别可能是:①第 2min;②第 6min;
(3)反应在第4min建立平衡,此温度下该反应的化学平衡常数 K= .
(4)判断第9min时(是/否)达平衡,说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),醋酸的电离平衡(填“向左”、“向右”或“不”)移动;常温下,另取10mL的乙溶液,加水稀释过程中,下列表达式的数据一定增大的是 .
A.c(H+) B. ![]() C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D. ![]()
(2)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)V(乙)( 填“>”、“<”或“=”).
(3)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×10﹣5 | 4.3×10﹣7 | 3.0×10﹣8 |
K2 | ﹣﹣ | 5.6×10﹣11 | ﹣﹣ |
下列四种离子水解程度最大的是 .
A.HCO3﹣
B.CO32﹣
C.ClO﹣
D.CH3COO﹣
(4)常温下,取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( ) 
A.A点pH小于7是因为Cu2+水解使溶液显酸性
B.BC段阳极产物是Cl2
C.整个过程中阳极先产生Cl2 , 后产生O2
D.CD段电解的物质是水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图. 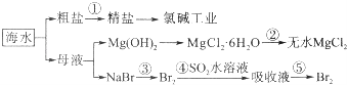
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣等离子.
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的 .
(2)除去粗盐溶液中的杂质(Mg2+、SO42﹣、Ca2+),加入药品的顺序可以为(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl26H2O制得无水MgCl2 , 应如何操作 .
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程.采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为
(5)从第③步到第④步的目的是 . 采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收.主要反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com