
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A、反应在前t1 s 的平均速率v(O2)=
| ||
| B、保持其他条件不变,体积压缩到1.0L,平衡常数将增大 | ||
| C、相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率大于10% | ||
D、保持温度不变,向该容器中再充入2mol SO2、1mol O2,反应达到新平衡时
|
| △c |
| △t |
| △c |
| △t |
| ||
| t1 |
| 0.4 |
| t1 |
| 1 |
| 2 |
| 0.4 |
| t1 |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| A、E(4s)>E(3s)>E(2s)>E(1s) |
| B、E(4s)>E(3d)>E(3p)>E(3s) |
| C、E(5s)>E(4f)>E(4s)>E(3d) |
| D、E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离的c(H+):①=②=③=④ |
| B、若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| B、液溴易挥发,在存放液溴的试剂瓶中应加水封存 |
| C、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D、某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定存在Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
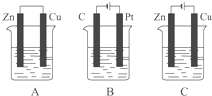 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com