
【题目】已知O3分子为V形结构,O3和O2在水中的溶解度比较正确的是
A.O3在水中的溶解度和O2一样 B.O3在水中的溶解度比O2小
C.O3在水中的溶解度比O2要大 D.没办法比较
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A. 过滤时,玻璃棒与三层滤纸
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4︰4︰5︰1︰1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl。回答下列问题。
(1)元素D在周期表中的位置是 ,B原子的外围电子排布图为 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系是 。(用元素符号表示)
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1︰1和l︰2,写出原子个数比为1︰1的化合物的电子式 ,两种化合物可以任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的化合物,该化合物的分子具有平面结构,则其结构式为 ,用电子式表示化合物Na2D的形成过程 。
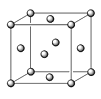
(5)已知E的晶胞结构如图所示,此晶胞立方体的边长为a cm,E单质的密度为ρ g·cm-3,则阿伏伽德罗常数为 (用a、ρ表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC42-的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的基本操作中,正确的是( )
A.用同一个滴管取用不同的药品
B.将实验中剩余的药品放回原试剂瓶
C.实验前对实验装置进行气密性检查
D.将实验室制备的可燃性气体直接点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将体积为V1的 0.1000mol·L-1HCl 溶液逐滴加入到体积为V2的0.1000mol·L-1Na2CO3溶液中,溶液中H2CO3、HCO3-、CO32-所占的物质的量分数(α)随pH的变化曲线如图。下列说法不正确的是
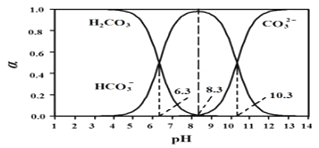
A. 在pH=10.3时,溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-)
B. 在pH=8.3时,溶液中:0.1000>c(HCO3-)+c(CO32-)+c(H2CO3)
C. 在pH=6.3时,溶液中,c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(OH-)
D. V1:V2=1:2时,c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)= c(CH3COO-)+ c(OH-)
B.加入少量CH3COONa固体后,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是
A.v(A)=0.9 mol /(L·s) B.v(B)=0.5 mol/(L·s)
C.v(C)=1.4 mol /(L·s) D.v(D)=1.8 mol /(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com