
【题目】(1)向苯和苯酚的混合液中加入浓溴水,然后过滤以除去苯酚。(_______)
(2)苯酚沾到皮肤上可以用氢氧化钠溶液洗涤。(_______)
(3)苯酚显酸性,属于羧酸类物质。(_______)
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是 ( )
A.苯酚呈弱酸性,能使石蕊试液显浅红色
B.苯酚分子中的13个原子一定处于同一平面上
C.苯酚有强腐蚀性,沾在皮肤上可用酒精洗涤
D.苯酚能与FeCl3溶液反应生成紫色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I彩色水泥墙含氯化亚钴可作睛雨表。下表为几种氯化亚钻的晶体颜色:
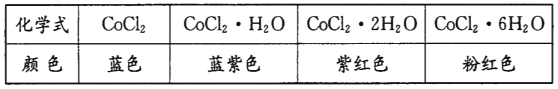
淋雨时彩色水泥墙的颜色为________。
Ⅱ从含钻废料(含CoO、Co2O3及金属Al、Li)中制取粗CoO的流程如下:

(1)步骤I产生的气体是________ (填化学式,下同),从含铝溶液中沉淀铝可通入的气体是________。
(2)步骤Ⅲ中除去A13+的离子方程式为________,步骤Ⅳ中Na2CO3溶液的作用是________(用离子方程式表示)。
(3)为了获得高纯度的钴粉,从环保角度考虑,还原Co2O3的试剂为________ (填序号)。
A.铝 B.木炭 C氢气 D.一氧化碳
(4)实验室制备氯化亚钴晶体并测其化学式的流程如下:

①步骤Ⅱ“系列操作”中洗涤晶体不用蒸馏水而用酒精,目的是________。
②用灼烧一称重法测定氯化亚钴晶体中结晶水含量时,需要在氯化氢氛围中灼烧结晶水合物,请结合方程式解释这样做的原因________。
③已知几种物质在20℃时的Ksp如下表:

某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是________(填编号)。
A KCl B KSCN C K2S D K2CrO4
若取样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用c mol / L AgNO3溶液滴定至终点消耗标准溶液bmL,则x的表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查尔酮是一种能制备抗炎药物的化工原料。其中一种合成路线如下:

(1)B的名称为_________;查尔酮含有的含氧官能团名称是_________。
(2)A→B的反应类型是_________;C的结构简式为_________。
(3)写出E→F的化学方程式_________。
(4)F的同分异构体中,含有![]() 结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
(5)已知: 。参照上述流程,以CH2=CH-CH3为原料合成
。参照上述流程,以CH2=CH-CH3为原料合成  ,设计最简合成路线。_______________
,设计最简合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
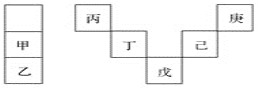
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。
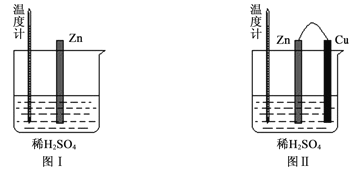
A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以![]() 固体为电解质传递
固体为电解质传递![]() ,其基本结构如图,电池总反应可表示为
,其基本结构如图,电池总反应可表示为![]() ,下列有关说法正确的是
,下列有关说法正确的是![]()
![]()
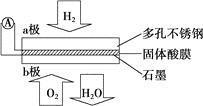
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为![]()
C. 每转移![]() 电子,消耗标准状况下
电子,消耗标准状况下![]()
D. ![]() 由a极通过固体酸电解质传递到b极
由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅及其化合物可用于蓄电池,耐酸设备及 X 射线防护材料等。回答下 列问题:
①铅是碳的同族元素,比碳多 4 个电子层。铅的原子结构示意图为_____;铅的最高价氧化物对应水化物的酸性比碳酸的______(填“强”或“弱”)。
②PbO2 与浓盐酸共热生成黄绿色气体,反应的化学方程式为_____。
③铅蓄电池放电时的正极反应式为_____ ,当电路中有 2mol 电子转移时,理论上两电极质量变化的差为_____g。
(2)NO2、O2 和熔融 NaNO3 可制作燃料电池,其原理见下图,石墨Ⅰ为电池的_____极;该电池在使用过程中石墨Ⅰ电极上生成氧化物 Y,其电极反应式为_____。
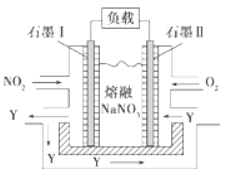
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com