
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:4 | D:E=1:3 | B:E=1:4 |
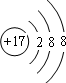 ,由于氯原子最外层有7个电子,所以它的最高化合价为+7价,
,由于氯原子最外层有7个电子,所以它的最高化合价为+7价, ;+7;
;+7;

 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| A、NaX、NaY、NaZ |
| B、NaZ、NaY、NaX |
| C、NaY、NaZ、NaX |
| D、NaX、NaZ、NaX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | ||||
| B、小苏打溶液中加足量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | ||||
C、用石墨作电极电解饱和NaCl溶液:2Cl-+2H2O
| ||||
| D、向氯化铝溶液中通入过量的氨气:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为17 |
| C、Z元素的最高化合价为+7价 |
| D、Y元素的最高价氧化物的对应水化物能溶解所有的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0mol?L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0mol?L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若 ②若 |
步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1mol?L-1的BaCl2溶液,充分振荡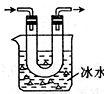 | 结合上述步骤1的有关结论 ①若 ②若 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com