
【题目】Ⅰ![]() 利用下图装置验证同主族元素非金属性的变化规律。
利用下图装置验证同主族元素非金属性的变化规律。
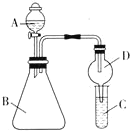
(1)若要证明非金属性:Cl>I,A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气![]() ,C中加淀粉碘化钾溶液,观察到C溶液中的现象是__________,即可证明。可用__________溶液吸收尾气。
,C中加淀粉碘化钾溶液,观察到C溶液中的现象是__________,即可证明。可用__________溶液吸收尾气。
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,观察到C中溶液的现象是__________,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
Ⅱ![]() 利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
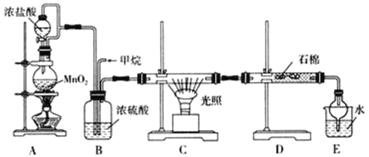
(1)A中制取氯气反应的化学方程式是_______________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是__________。
(3)E装置的作用是_________(填序号)。
A.收集气体 B. 吸收氯气 C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是__________。
(5) 将1molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是____。
【答案】无色溶液变蓝 NaOH 生成白色沉淀 饱和碳酸氢钠 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2 C 分液 2.5mol
MnCl2+Cl2↑+2H2O 除去Cl2 C 分液 2.5mol
【解析】
I.(1)根据非金属性越强单质的氧化性越强分析;
(2)根据非金属性越强最高价氧化物的酸性越强分析;
Ⅱ.本实验的目的是利用甲烷与氯气发生取代反应的副产品生产盐酸,首先在装置A中利用浓盐酸和二氧化锰共热制取氯气,甲烷和生成的氯气经浓硫酸干燥后通入B装置在光照条件下发生取代反应,D中用吸附着潮湿的KI粉末的石棉吸收未反应的氯气,装置E中用水吸收生成的HCl气体,同时有取代反应的有机产物冷凝,与生成的盐酸分层,可分液分离得到盐酸;HCl极易溶于水,干燥管可以防止倒吸。
I.(1)浓盐酸和高锰酸钾反应生成的氯气进入装置C中,根据非金属性越强单质的氧化性越强可知,若氯气将淀粉碘化钾溶液中的碘离子氧化成碘单质,则可以证明Cl的非金属性更强,而淀粉遇碘变蓝,所以当观察到无色溶液变蓝,即可证明非金属性Cl>I;氯气可以和NaOH反应,所以可以用NaOH溶液吸收尾气;
(2)盐酸可以和碳酸钙反应生成二氧化碳,二氧化碳进入C装置,根据非金属性越强,最高价氧化物的酸性越强,若装置C中生成硅酸,则可证明非金属C>Si,而硅酸不溶于水,所以观察到C中生成白色沉淀,即可证明;二氧化碳中混有的HCl气体可用饱和碳酸氢钠溶液除去;
Ⅱ.(1)浓盐酸和二氧化锰共热生成氯气的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)潮湿的KI粉末可用除去HCl中未反应的Cl2;
(3)E装置的作用是吸收反应生成的HCl,所以选C;
(4)生成的有机物与盐酸不互溶,所以可以分液分离得到盐酸;
(5)将1molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,即生成的CH3Cl、CH2Cl2、CHCl3、CCl4均为0.25mol,根据元素守恒可知Cl原子为2.5mol,取代反应中有一个氯原子取代一个氢原子的同时还会生成一个HCl,所以HCl还有2.5molCl原子,所以消耗的氯气的物质的量为2.5mol。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭常用的高能燃料,常温下为液体,其球棍模型如下图,肼与双氧水反应:N2H4+2H2O2 = N2↑+4H2O 。下列说法正确的是( )

A. 标准状况下,11.2 L N2H4中含电子总数为5NA
B. 标准状况下,22.4 L N2H4中所含原子总数为6NA
C. 标准状况下,3.2 g N2H4中含有共价键的总数为0.6NA
D. 若生成3.6 g H2O,则反应转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反应式为I2+2![]() =2I+
=2I+![]() 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:
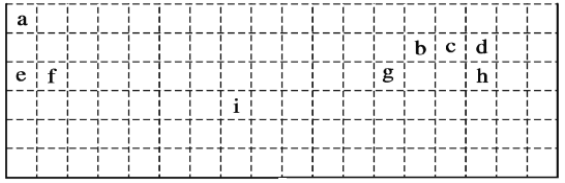
(1)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___(填元素符号)。
(2)实验室制ca3的化学反应方程式为_______________。
(3)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为_____________。
(4)设计实验验证b、c非金属性的强弱 _________________。
(5)i在周期表中的位置为___。i对应的单质与h对应的单质反应的化学方程式为_________。
(6)e2d2的电子式为______;用电子式表示fCl2的形成过程________________。
(7)写出工业冶炼元素g的单质的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来流行喝苹果醋。苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:

下列相关说法正确的是( )
A. 苹果酸在一定条件下能发生消去反应
B. 苹果酸在一定条件下能催化氧化生成醛
C. 苹果酸在一定条件下能发生加聚反应生成高分子化合物
D. 1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:
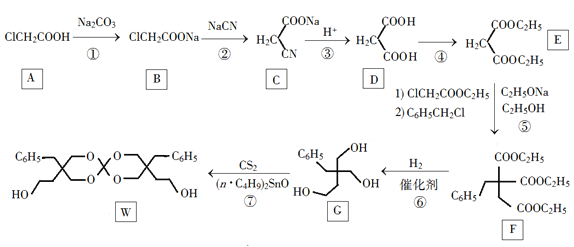
回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯(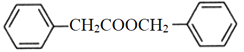 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原型糖,而其水解产物具有还原性的实验方案的说法中,正确的是

A. 验证蔗糖属于非还原型糖的操作顺序:④③
B. 验证蔗糖属于非还原型糖的操作顺序:③⑤
C. 验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D. 验证蔗糖水解产物具有还原性的操作顺序:①⑤②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是合成药物格列卫的一种重要中间体,J的一种合成路线如下:

已知:①
②R-NH2 R-NH2
R-NH2
回答下列问题:
(1)B的名称为________。
(2)H→I和I→J的反应类型分别为________、________。
(3)G的结构简式为________。
(4)由E生成F的化学方程式为_______________________________________________。
(5)芳香化合物X是E的同分异构体,X能发生银镜反应,并能发生水解反应,其核磁共振氢谱有4组峰,峰面积之比为1∶4∶2∶1,写出符合条件的X的结构简式________________
(6)写出用甲苯为原料制备聚合物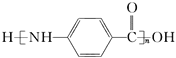 的合成路线:_______________
的合成路线:_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com