
����Ŀ������������գ�
��1������һԪ������Է�������Ϊ88�����ж���ͬ���칹�壬���в��ܷ�����������Ӧ�Ľṹ��ʽΪ�������ܷ�����ȥ��Ӧ�Ľṹ��ʽΪ����
��2���������͡�����������﹤�����й㷺��Ӧ��ǰ����PMAA����һ�֡������͡�����ӣ�������������ҩ�д������С���ӵķ��룬������������AΪ��ʼ��Ӧ��ϳ�PMAA��·�ߣ�
�����������̻ش��������⣺
��д���ṹ��ʽ��A PMAA
��д�����������еķ�Ӧ���ͣ�����
��д���۵Ļ�ѧ����ʽ
��д��E��һ���������γ��л��߷��ӵĻ�ѧ����ʽ ��
���𰸡�
��1��HOC��CH3��2CH2CH3,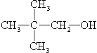
��2��CH2=C��CH3����CH3,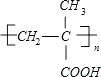 ,�ӳɷ�Ӧ,��ȥ��Ӧ,2
,�ӳɷ�Ӧ,��ȥ��Ӧ,2  +O2
+O2 ![]() 2
2  +2H2O,n
+2H2O,n 
![]()
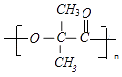 +nH2O
+nH2O
���������⣺��1������һԪ������Է�������Ϊ88�������ʽΪC5H12O������ͬ���칹���У����ܷ�����������˵�������ǻ���̼ԭ���ϲ�������ԭ�ӣ���ṹ��ʽΪHOC��CH3��2CH2CH3�����ܷ�����ȥ��Ӧ��˵�����ǻ�����̼���©�C�ϲ�������ԭ�ӣ��ṹ��ʽΪ�� 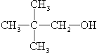 ��
��
�ʴ�Ϊ��HOC��CH3��2CH2CH3��  ��
��
��2����������������֪��A�Ľṹ��ʽΪCH2=C��CH3����CH3��PMAA�Ľṹ��ʽΪ��  ��
��
�ʴ�Ϊ��CH2=C��CH3����CH3��  ��
��
�ڷ�Ӧ����ϩ�������ӳɷ�Ӧ����Ӧ���Ǵ�������ȥ��Ӧ����̼̼˫����
�ʴ�Ϊ���ӳɷ�Ӧ����ȥ��Ӧ��
�۷�Ӧ�۵Ļ�ѧ����ʽ��2  +O2
+O2 ![]() 2
2 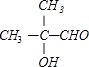 +2H2O��
+2H2O��
�ʴ�Ϊ��2  +O2
+O2 ![]() 2
2 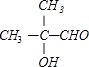 +2H2O��
+2H2O��
��E�� 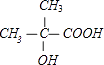 ����һ���������γ��л��߷��ӵĻ�ѧ����ʽΪ��n
����һ���������γ��л��߷��ӵĻ�ѧ����ʽΪ��n 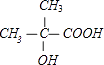
![]()
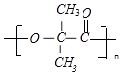 +nH2O��
+nH2O��
�ʴ�Ϊ��n 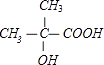
![]()
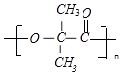 +nH2O��
+nH2O��
��1�����ݱ���һԪ����ͨʽ����Է���������ȷ�������ʽ���ٸ�������ͬ���칹���У����ܷ�����������˵�������ǻ���̼ԭ���ϲ�������ԭ�ӣ����ܷ�����ȥ��Ӧ����ȷ������ͬ���칹�壻
��2����F����̼̼˫���������Ӿ۷�Ӧ���ɸ߷��ӻ�����PMAAΪͻ�ƿڣ��Ƶ����������ʣ�Ȼ����з����ش����⼴�ɣ�


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ������ϳɲ��ϵĻ���ԭ�ϣ������ںϳ�Ӧ�ù㷺��DAP��֬�����˫�ӵ��л��������Ҫ�Ĺ�ҵ��;��
��1��д����ϩ��һ�������·����ۺϷ�Ӧ�Ļ�ѧ����ʽ ��
��2����ϩ��������������O2��Ӧ�����л���A���������ܶ�����ͬ״���¼����ܶȵ�6.25����Ԫ�ص���������Ϊ��̼60%����32%��A�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ṹ��ʽΪ ![]() �����ڸ��л�������������ȷ���ǣ�������
�����ڸ��л�������������ȷ���ǣ�������
A.����ʹ����KMnO4��Һ��ɫ
B.�ڼ��Ⱥʹ��������£�����ܺ�5mol H2��Ӧ
C.��ʹ��ˮ��ɫ
D.һ�������£��ܺ�NaOH����Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�̼�����ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���塣
(1) �û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ������ ����̿��NO������ ��ӦC(s)+2NO(g) ![]() N2(g)+CO2(g)��H=QkJ/mol�� ��T1��ʱ����Ӧ���е���ͬʱ��(min) ��ø����ʵ�Ũ��(mol/L) ���£�
N2(g)+CO2(g)��H=QkJ/mol�� ��T1��ʱ����Ӧ���е���ͬʱ��(min) ��ø����ʵ�Ũ��(mol/L) ���£�
Ũ�� ʱ�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��30min ��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������________(����ĸ���)
a.ͨ��һ������NO b.���붨���Ļ���̿
c.������ʵĴ��� d.�ʵ���С���������
�� ��30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3: 1: 1����Q_____ 0 (�>����<��<)��
(2) ij�о�С����ʵ������ij���ʹ�����CO��NO��ת�������о������NOת��ΪN2��ת�������¶ȡ�CO������ı仯�������ͼ��ʾ���������·�Ӧ��NO+CO![]() N2+CO2( ��CO) 2NO
N2+CO2( ��CO) 2NO![]() N2+ O2 (��CO)
N2+ O2 (��CO)

������ʹ��CO���¶ȳ���775�棬����NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ: __________����n(NO)/n(CO)= 1�������£�Ӧ��������¶���_______���ҡ�
����CxHy(��)����ԭNOxҲ�����������������Ⱦ��д��C2H6��NO2������Ӧ�Ļ�ѧ����ʽ_________________��
����NO2��O2 ����NaNO3
(3) ��Ȼ����һ����Ҫ��;����ȡ��������ԭ�����£�

��֪:�� 2CO(g)+O2(g)=2CO2(g) ��H1
��CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ��H2
��2H2(g)+O2(g)=2H2O(l) ��H3
1)��ѧ�����һ��������Ȼ���Ʊ������ķ���: CH4(g)+ CO2(g)=2CO(g)+2H2(g) ��H=_____
2)���ַ������ƹ���ʹ�ã�����ʵ����Դ�ۺ����ã����һ��ܽ������������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ����Ƽ��ţ����Ľṹ��ʽ��ͼ���й���Ƽţ�����������ȷ����

A. ����ʽ�ֱ�Ϊ C10H16ON��C2H7NO2S
B. ����������Ƽ�����������Һ��Ӧ
C. ���ܷ���ȡ����Ӧ����Ƽ�ܷ����ӳɷ�Ӧ
D. ţ������HSCH2CH( NH2)COOH( ���װ���) ��Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ĺ��ɽ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ�������ǿ�Ͻ��ǿ�ȡ�Ӳ�ȡ��ɺ��Եȡ������ƾ���(Na2MoO4��2H2O)����Ϊ��������ȴˮϵͳ�Ľ�����ʴ���Ƽ�����ͼ15�ǻ����������Ի����(��Ҫ�ɷ�Ϊ����MoS2)Ϊԭ�����Ʊ������⡢�����ƾ������Ҫ����ͼ��
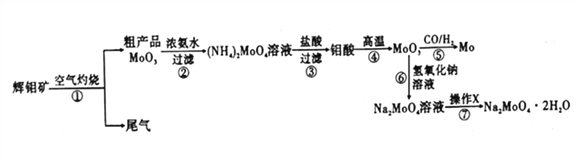
�ش���������:
��1����֪��Ӧ��Ϊ���ֽⷴӦ����������Կ�Ļ��ϼ�Ϊ___________��
��2����Ӧ�������ӷ���ʽΪ___________��
��3�����������ʱ�Ļ�ѧ����ʽΪ____________��
��4������XΪ_________����֪��������һ���¶ȷ�Χ�ڵ��������ʼ���Ӧ���ʵ��ܽ�����±���ʾ�����ڲ���X��Ӧ�����¶ȵ���ѷ�ΧΪ_______(�����)��
�¶�(��) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
�������� | Na2MoO4��10H2O | Na2MoO4��2H2O | Na2MoO4 | ||||||
�ܽ�� | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0�桫10�� B.10�桫100�� C.15.5�桫50�� D.100������
��5���Ʊ������ƾ��廹����ͨ�����ƵĻ������ֱ�Ӽ������������Һ�����ķ����������������У��������������ɣ����������뻹ԭ�������ʵ���֮��Ϊ_________��
��6��Li��MoS2�ɳ���صĹ���ԭ��ΪxLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n�����ڵ缫��]�����س��ʱ�����ĵ缫��ӦʽΪ___________________��
Lix(MoS2)n[Lix(MoS2)n�����ڵ缫��]�����س��ʱ�����ĵ缫��ӦʽΪ___________________��
��7�����û�ԭ������(CO��H2)��ԭMoO3���⣬ҵ���Ʊ���ԭ������CO��H2�ķ�Ӧԭ��֮һΪCO2+CH4![]() 2CO+2H2���������������Ϊ90%��7L(��״��)��Ȼ��������������̼�ڸ����·�Ӧ������ת����Ϊ80%,�ò�����CO��H2��ԭMoO3���⣬�������������������Ϊ_________��
2CO+2H2���������������Ϊ90%��7L(��״��)��Ȼ��������������̼�ڸ����·�Ӧ������ת����Ϊ80%,�ò�����CO��H2��ԭMoO3���⣬�������������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͪ�������п��������ԣ�6���ǻ���ͪ������ĺϳ�·����ͼ��
��ش��������⣺
��1��������B�еĺ���������Ϊ���������ƣ���
��2����Ӧ�����漰���ķ�Ӧ������ˮ�ⷴӦ���� ��
��3����Ӧ���м�����Լ�X�ķ���ʽΪC7H5OCl��X�Ľṹ��ʽΪ ��
��4����֪��  ��
��
��������֪ʶ����������Ϣ��д���� ![]() ��CH3COOHΪԭ���Ʊ�
��CH3COOHΪԭ���Ʊ� �ĺϳ�·������ͼ�����Լ���ѡ����
�ĺϳ�·������ͼ�����Լ���ѡ����
�ϳ�·������ͼʾ�����£�
H2C�TCH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH��
CH3CH2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֱ��úȼ�ϵ�ء��ܹ���ú�еĻ�ѧ�ܸ�Ч������ת��Ϊ���ܣ���ͼ���ù����������� ��ֱ��úȼ�ϵ�ء��ĵ���ʡ��й�˵����ȷ����

A. �缫bΪ��صĸ���
B. ��ط�ӦΪ��C + CO2 = 2CO
C. �����ɵ缫a�ص�������b
D. úȼ�ϵ�ر�úֱ��ȼ�շ������������ʵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MOH��ROH����һԪ�����Һ�ֱ��ˮϡ��ʱ��pH�仯������ͼ��ʾ��������������ȷ���ǣ�������
A.ROH��һ������
B.��x�㣬c��M+��=c��R+��
C.��x�㣬MOH��ȫ����
D.ϡ��ǰ��c��ROH��=10 c��MOH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com