
°ĺŐ‚ńŅ°ŅÓ‚ «“Ľ÷÷÷ō“™ĶńĻż∂…Ĺū Ű‘™ňō£¨Õ®≥£”√◊ųļŌĹūľį≤Ľ–‚ł÷ĶńŐŪľ”ľŃ£¨Ņ…‘Ų«ŅļŌĹūĶń«Ņ∂»°Ę”≤∂»°ĘŅ…ļł–‘Ķ»°£Ó‚ňŠń∆ĺßŐŚ(Na2MoO4°§2H2O)Ņ…◊ųő™őřĻęļ¶–Õņš»īňģŌĶÕ≥ĶńĹū ŰłĮ ī“÷÷∆ľŃ£¨»ÁÕľ15 «ĽĮĻ§…ķ≤ķ÷–“‘Ľ‘Ó‚Ņů(÷ų“™≥…∑÷ő™ŃÚĽĮÓ‚MoS2)ő™‘≠ŃŌņī÷∆ĪłĹū ŰÓ‚°ĘÓ‚ňŠń∆ĺßŐŚĶń÷ų“™Ńų≥ŐÕľ°£
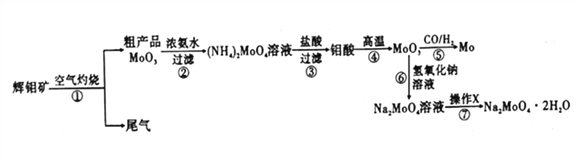
ĽōīūŌ¬Ń–ő Ő‚:
£®1£©“—÷™∑ī”¶ĘŘő™łī∑÷Ĺ‚∑ī”¶£¨‘ÚÓ‚ňŠ÷–‘ŅĶńĽĮļŌľŘő™___________°£
£®2£©∑ī”¶ĘřĶńņŽ◊”∑Ĺ≥Ő Ĺő™___________°£
£®3£©Ľ‘Ó‚Ņů◊∆…’ ĪĶńĽĮ—ß∑Ĺ≥Ő Ĺő™____________°£
£®4£©≤Ŕ◊ųXő™_________°£“—÷™Ó‚ňŠń∆‘ŕ“Ľ∂®ő¬∂»∑∂őßńŕĶńőŲ≥ŲőÔ÷ ľįŌŗ”¶őÔ÷ Ķń»‹Ĺ‚∂»»ÁŌ¬ĪŪňý ĺ£¨‘Ú‘ŕ≤Ŕ◊ųX÷–”¶Ņō÷∆ő¬∂»Ķń◊Óľ—∑∂őßő™_______(ŐÓ–ÚļŇ)°£
ő¬∂»(°ś) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
őŲ≥ŲőÔ÷ | Na2MoO4°§10H2O | Na2MoO4°§2H2O | Na2MoO4 | ||||||
»‹Ĺ‚∂» | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0°ś°ę10°ś B.10°ś°ę100°ś C.15.5°ś°ę50°ś D.100°ś“‘…Ō
£®5£©÷∆ĪłÓ‚ňŠń∆ĺßŐŚĽĻŅ…”√Õ®ĻżŌÚĺę÷∆ĶńĽ‘Ó‚Ņů÷–÷ĪĹ”ľ”»Žīő¬»ňŠń∆»‹“ļ—űĽĮĶń∑Ĺ∑®£¨»Ű—űĽĮĻż≥Ő÷–£¨ĽĻ”–ŃÚňŠń∆…ķ≥…£¨‘Ú—űĽĮľŃ”ŽĽĻ‘≠ľŃĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™_________°£
£®6£©Li°ĘMoS2Ņ…≥šĶÁĶÁ≥ōĶńĻ§◊ų‘≠ņŪő™xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)nłĹ◊Ň‘ŕĶÁľę…Ō]£¨‘ÚĶÁ≥ō≥šĶÁ Ī—ŰľęĶńĶÁľę∑ī”¶ Ĺő™___________________°£
Lix(MoS2)n[Lix(MoS2)nłĹ◊Ň‘ŕĶÁľę…Ō]£¨‘ÚĶÁ≥ō≥šĶÁ Ī—ŰľęĶńĶÁľę∑ī”¶ Ĺő™___________________°£
£®7£©Ņ…”√ĽĻ‘≠–‘∆ÝŐŚ(COļÕH2)ĽĻ‘≠MoO3÷∆Ó‚£¨“Ķ…Ō÷∆ĪłĽĻ‘≠–‘∆ÝŐŚCOļÕH2Ķń∑ī”¶‘≠ņŪ÷ģ“Ľő™CO2+CH4![]() 2CO+2H2°£ļ¨ľ◊ÕťŐŚĽż∑÷ żő™90%Ķń7L(ĪÍ◊ľ◊īŅŲ)Őž»Ľ∆Ý”Ž◊„ŃŅ∂Ģ—űĽĮŐľ‘ŕłŖő¬Ō¬∑ī”¶£¨ľ◊Õť◊™ĽĮ¬ ő™80%,”√≤ķ…ķĶńCOļÕH2ĽĻ‘≠MoO3÷∆Ó‚£¨ņŪ¬Ř…Ōń‹…ķ≤ķÓ‚Ķń÷ ŃŅő™_________°£
2CO+2H2°£ļ¨ľ◊ÕťŐŚĽż∑÷ żő™90%Ķń7L(ĪÍ◊ľ◊īŅŲ)Őž»Ľ∆Ý”Ž◊„ŃŅ∂Ģ—űĽĮŐľ‘ŕłŖő¬Ō¬∑ī”¶£¨ľ◊Õť◊™ĽĮ¬ ő™80%,”√≤ķ…ķĶńCOļÕH2ĽĻ‘≠MoO3÷∆Ó‚£¨ņŪ¬Ř…Ōń‹…ķ≤ķÓ‚Ķń÷ ŃŅő™_________°£
°ĺīūįł°Ņ +6 MoO3+2OH=![]() +
+![]() 2MoS2+7O2
2MoS2+7O2![]() 2MoO3+4SO2 ’Ű∑ĘŇ®ňű°Ęņš»īĹŠĺß C 9©U1 Lix(MoS2)n xe = nMoS2 +xLi+ 28.8g
2MoO3+4SO2 ’Ű∑ĘŇ®ňű°Ęņš»īĹŠĺß C 9©U1 Lix(MoS2)n xe = nMoS2 +xLi+ 28.8g
°ĺĹ‚őŲ°Ņ£®1£©łýĺ›Ó‚ňŠÔ߼Į—ß ĹŅ…÷™£¨Ó‚‘™ňōĽĮļŌľŘő™+6ľŘ£¨”…”ŕ∑ī”¶ĘŘő™łī∑÷Ĺ‚∑ī”¶£¨‘ÚÓ‚ňŠ÷–Ó‚ĶńĽĮļŌľŘő™+6ľŘ£Ľ’ż»∑īūįł£ļ+6°£
£®2£©»ż—űĽĮÓ‚”Ž«ŅľÓ»‹“ļ∑ī”¶…ķ≥…Na2MoO4ļÕňģ£¨∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™MoO3+2OH=![]() +
+![]() £Ľ’ż»∑īūįł£ļ. MoO3+2OH=
£Ľ’ż»∑īūįł£ļ. MoO3+2OH=![]() +
+![]() °£
°£
£®3£©łýĺ›Ńų≥ŐÕľŅī≥Ų£¨Ľ‘Ó‚Ņů‘ŕ—ű∆Ý÷–◊∆…’…ķ≥…MoO3£¨ĽĮ—ß∑Ĺ≥Ő Ĺő™2MoS2+7O2![]() 2MoO3+4SO2 £Ľ’ż»∑īūįł£ļ2MoS2+7O2
2MoO3+4SO2 £Ľ’ż»∑īūįł£ļ2MoS2+7O2![]() 2MoO3+4SO2°£
2MoO3+4SO2°£
£®4£©”…Na2MoO4»‹“ļĪšő™Na2MoO42H2OĺßŐŚ£¨–Ť“™ĹÝ––Ķń’Ű∑ĘŇ®ňű°Ęņš»īĹŠĺߣĽłýĺ›ĪŪ÷– żĺ›Ņ…÷™“™–ő≥…Na2MoO42H2OĺßŐŚ£¨15.5°ś°ę50°ś ∑∂őßńŕ◊Óļ√£¨C’ż»∑£Ľ.’ż»∑īūįł£ļ’Ű∑ĘŇ®ňű°Ęņš»īĹŠĺߣĽC°£
£®5£©īő¬»ňŠń∆◊Ų—űĽĮľŃ£¨ĪĽĽĻ‘≠ő™¬»ĽĮń∆£¨Ľ‘Ó‚Ņů÷–MoS2◊ŲĽĻ‘≠ľŃ£¨ĪĽ—űĽĮő™Na2MoO4ļÕŃÚňŠłýņŽ◊”£¨…Ťīő¬»ňŠń∆”–xmol£¨MoS2 ymol£¨łýĺ›ĶÁ◊” ōļ„Ļś¬…£ļx°Ń£®1-£®-1£©£©=y°Ń£®6-4+{6-£®-2£©}°Ń2£©£¨x£ļy=9:1£¨’ż»∑īūįł£ļ9:1°£
£®6£©∑ŇĶÁő™‘≠ĶÁ≥ō£¨≥šĶÁő™ĶÁĹ‚≥ō£¨ĶÁĹ‚≥ō—Űľę∑Ę…ķ—űĽĮ∑ī”¶£¨Lix(MoS2)n ßĶÁ◊”Īšő™MoS2£¨ĶÁľę∑ī”¶ Ĺő™ Lix(MoS2)n xe = nMoS2 +xLi+ £Ľ’ż»∑īūįł£ļLix(MoS2)n xe = nMoS2 +xLi+ °£
£®7£©łýĺ›CO2£ęCH4![]() 2CO£ę2H2£¨1ŐŚĽżĶńľ◊Õť∑Ę…ķ∑ī”¶…ķ≥…4ŐŚĽżĶńĽĻ‘≠–‘∆ÝŐŚ£¨∆ÝŐŚ◊‹ŐŚĽżő™7°Ń90%°Ń80%°Ń4=20.16L£Ľ…ķ≥…1molMoŌŻļń3molCOĽÚH2£¨ňý“‘…ķ≥…n(Mo)= 20.16/£®22.4°Ń3£©=0.3mol£¨Ó‚Ķń÷ ŃŅő™m(Mo)= 0.3°Ń96=28.8 g£Ľ’ż»∑īūįł£ļ28.8 g°£
2CO£ę2H2£¨1ŐŚĽżĶńľ◊Õť∑Ę…ķ∑ī”¶…ķ≥…4ŐŚĽżĶńĽĻ‘≠–‘∆ÝŐŚ£¨∆ÝŐŚ◊‹ŐŚĽżő™7°Ń90%°Ń80%°Ń4=20.16L£Ľ…ķ≥…1molMoŌŻļń3molCOĽÚH2£¨ňý“‘…ķ≥…n(Mo)= 20.16/£®22.4°Ń3£©=0.3mol£¨Ó‚Ķń÷ ŃŅő™m(Mo)= 0.3°Ń96=28.8 g£Ľ’ż»∑īūįł£ļ28.8 g°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ¬»ĽĮÔ”(CdCl2) «“Ľ÷÷≥£”√”ŕĪ°ń§Őę—Űń‹ĶÁ≥ō…ŌĶńőÔ÷ £¨”…”ŕňŁ”–∂ĺ£¨Ņ∆—ßľ“—°”√ŃňŃŪ“Ľ÷÷—őņīŐśīķňŁ°£’‚÷÷ŐśīķőÔ÷ «(°°°°)
A. Cl2 B. HCl C. MgCl2 D. Mg(OH)2
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŐĹĺŅĹū Űń∆”Ž—ű∆Ý∑÷Īū‘ŕ≥£ő¬ļÕľ”»»ŐűľĢŌ¬Ķń∑ī”¶°£Ō¬Ń–—–ĺŅ∑Ĺ∑®”√≤ĽĶĹĶń «
A. Ķ—ť∑®B.ĻŘ≤ž∑®C.∑÷ņŗ∑®D.Ī»ĹŌ∑®
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–ňĶ∑®÷–’ż»∑Ķń «
A. ∑÷◊”÷–Ļ≤ľŘľŁľŁń‹‘ĹłŖ£¨ľŁ≥§‘Ĺ≥§£¨‘Ú∑÷◊”‘Ĺő»∂®
B. ‘™ňō÷‹∆ŕĪŪ÷–ĶńĘÚA◊ŚļÕĘųA◊Ś‘™ňōĶń‘≠◊”ľš≤Ľń‹–ő≥…Ļ≤ľŘľŁ
C. ňģ∑÷◊”Ņ…ĪŪ ĺő™H°™O°™H£¨∑÷◊”÷–ľŁĹ«ő™180°„
D. N°™N°ĘN===N°ĘN°‘NľŁń‹÷ģĪ»ő™1.00£ļ2.17£ļ4.90£¨ňĶ√ųN2∑÷◊”÷–¶–ľŁľŁń‹>¶“ľŁľŁń‹
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņłýĺ›ő Ő‚ŐÓŅ’£ļ
£®1£©Ī•ļÕ“Ľ‘™īľĶńŌŗ∂‘∑÷◊”÷ ŃŅő™88£¨ňŁ”–∂ŗ÷÷Õ¨∑÷“žĻĻŐŚ£¨∆š÷–≤Ľń‹∑Ę…ķīŖĽĮ—űĽĮ∑ī”¶ĶńĹŠĻĻľÚ Ĺő™£ļ£Ľ≤Ľń‹∑Ę…ķŌŻ»•∑ī”¶ĶńĹŠĻĻľÚ Ĺő™£ļ£Ľ
£®2£©°į÷«ń‹–Õ°Īīů∑÷◊”‘ŕ…ķőÔĻ§≥Ő÷–”–Ļ„∑ļĶń”¶”√«įĺį£ģPMAAĺÕ «“Ľ÷÷°į÷«ń‹–Õ°Īīů∑÷◊”£¨Ņ…”√”ŕ…ķőÔ÷∆“©÷–īů∑÷◊””Ž–°∑÷◊”Ķń∑÷ņŽ£¨Ō¬Ń– «“‘őÔ÷ Aő™∆ū ľ∑ī”¶őÔļŌ≥…PMAAĶń¬∑ŌŖ£ģ
łýĺ›…Ō ŲĻż≥ŐĽōīūŌ¬Ń–ő Ő‚£ļ
ĘŔ–ī≥ŲĹŠĻĻľÚ Ĺ£ļA PMAA
Ęŕ–ī≥Ų…Ō ŲĻż≥Ő÷–Ķń∑ī”¶ņŗ–Õ£ļĘŔĘ‹
ĘŘ–ī≥ŲĘŘĶńĽĮ—ß∑Ĺ≥Ő Ĺ
Ę‹–ī≥ŲE‘ŕ“Ľ∂®ŐűľĢŌ¬–ő≥…”–ĽķłŖ∑÷◊”ĶńĽĮ—ß∑Ĺ≥Ő Ĺ £ģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĶ™Ķń—űĽĮőÔ «‘ž≥…īů∆ÝőŘ»ĺĶń÷ų“™őÔ÷ °£—–ĺŅĶ™—űĽĮőÔĶń∑ī”¶ĽķņŪ£¨∂‘”ŕŌŻ≥żĽ∑ĺ≥őػ唖÷ō“™“‚“Ś°£ĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©“—÷™2NO(g) +O2(g)![]() -2NO2(g) °ųHĶń∑ī”¶ņķ≥Ő∑÷ŃĹ≤Ĺ£ļ
-2NO2(g) °ųHĶń∑ī”¶ņķ≥Ő∑÷ŃĹ≤Ĺ£ļ
ĘŔ2NO( g )![]() N2O2 (g)( Ņž ) °ųH1<0£¨v1’ż=k1’żc2(NO)£¨v1ńś=k1ńśc2(N2O2)
N2O2 (g)( Ņž ) °ųH1<0£¨v1’ż=k1’żc2(NO)£¨v1ńś=k1ńśc2(N2O2)
ĘŕN2O2 (g)+ O2 (g) ![]() 2NO2(g)(¬ż) °ųH2<0£¨v2’ż=k2’żc2(N2O2)c(O2)£¨v2ńś=k2ńśc2(NO2)
2NO2(g)(¬ż) °ųH2<0£¨v2’ż=k2’żc2(N2O2)c(O2)£¨v2ńś=k2ńśc2(NO2)
Ī»ĹŌ∑ī”¶ĘŔĶńĽÓĽĮń‹E1”Ž∑ī”¶ĘŕĶńĽÓĽĮń‹E2Ķńīů–°: E1__ E2 (ŐÓ°į>°Ī°Ę°į<°ĪĽÚ°į=°Ī) ∆šŇ–∂ŌņŪ”… «__________£Ľ2NO(g) +O2(g)![]() 2NO2(g) Ķń∆Ĺļ‚≥£ żK”Ž…Ō Ų∑ī”¶ňŔ¬ ≥£ żk1’ż°Ęk1ńś°Ęk2’ż°Ę k2ńśĶńĻōŌĶ Ĺő™_______£Ľ“—÷™∑ī”¶ňŔ¬ ≥£ żkňśő¬∂»…żłŖ∂Ý‘Ųīů£¨»Ű…żłŖő¬∂»ļůk2’ż°Ę k2ńś∑÷Īū‘ŲīůaĪ∂ļÕbĪ∂£¨‘Úa____b (ŐÓ°į>°Ī°Ę°į<°ĪĽÚ°į=°Ī)£Ľ“Ľ∂®ŐűľĢŌ¬£¨2NO (g)+O2(g)
2NO2(g) Ķń∆Ĺļ‚≥£ żK”Ž…Ō Ų∑ī”¶ňŔ¬ ≥£ żk1’ż°Ęk1ńś°Ęk2’ż°Ę k2ńśĶńĻōŌĶ Ĺő™_______£Ľ“—÷™∑ī”¶ňŔ¬ ≥£ żkňśő¬∂»…żłŖ∂Ý‘Ųīů£¨»Ű…żłŖő¬∂»ļůk2’ż°Ę k2ńś∑÷Īū‘ŲīůaĪ∂ļÕbĪ∂£¨‘Úa____b (ŐÓ°į>°Ī°Ę°į<°ĪĽÚ°į=°Ī)£Ľ“Ľ∂®ŐűľĢŌ¬£¨2NO (g)+O2(g) ![]() 2NO2 (g)īÔ∆Ĺļ‚ļů£¨…żłŖĶĹń≥ő¬∂»£¨‘ŔīÔ∆Ĺļ‚ļův2’żĹŌ‘≠∆Ĺļ‚ľű–°£¨łýĺ›…Ō ŲňŔ¬ ∑Ĺ≥Ő∑÷őŲ£¨ļŌņŪĶńĹ‚ Õ «_________________°£
2NO2 (g)īÔ∆Ĺļ‚ļů£¨…żłŖĶĹń≥ő¬∂»£¨‘ŔīÔ∆Ĺļ‚ļův2’żĹŌ‘≠∆Ĺļ‚ľű–°£¨łýĺ›…Ō ŲňŔ¬ ∑Ĺ≥Ő∑÷őŲ£¨ļŌņŪĶńĹ‚ Õ «_________________°£
£®2£©ĘŔ“‘““Ō©(C2H4)◊ųő™ĽĻ‘≠ľŃÕ—Ōű(NO)£¨∆šÕ—ŌűĽķņŪ»Á◊ůŌ¬Õľňý ĺ£¨»Ű∑ī”¶÷–n(NO): n(O2) =2 £ļ1£¨‘Ú◊‹∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™_______________£ĽÕ—Ōű¬ ”Žő¬∂»°Ęłļ‘ō¬ (∑÷◊”…ł÷–īŖĽĮľŃĶń÷ ŃŅ∑÷ ż) ĶńĻōŌĶ»Á”“Ō¬Õľ£¨ő™īÔĶĹ◊Óľ—Õ—Ōű–ßĻŻ£¨”¶≤…”√ĶńŐűľĢ «________________°£
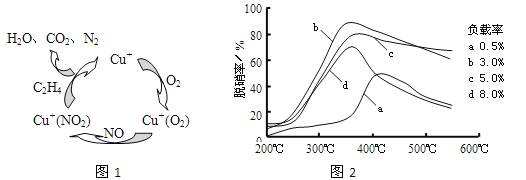
Ęŕ”√NOŅ…÷ĪĹ”īŖĽĮNO∑÷Ĺ‚…ķ≥…N2°ĘO2£¨Ĺę∆š∑ī”¶ĽķņŪ≤Ļ≥šÕÍ’Ż(VoīķĪŪ—űŅ’—®)£ļ
2Ni2++2Vo+2NO°ķ2Ni3++2O-+N2 2O-°ķO2-+1/2O2+Vo ______________
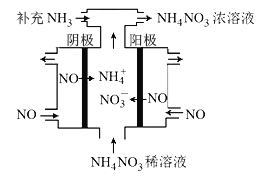
£®3£©ĶÁĹ‚NOŅ…÷∆ĪłNH4NO3£¨∆šĻ§◊ų‘≠ņŪ»ÁÕľňý ĺ£¨“űľęĶńĶÁľę∑ī”¶ Ĺő™______________°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–łų◊ťņŽ◊”ń‹‘ŕÕ¨“Ľ»‹“ļ÷–īůŃŅĻ≤īśĶń «
A.Ba2+°ĘNa£ę°Ę°ĘCl£≠°ĘSO42-B.H+°ĘK£ę°ĘNO3£≠°ĘCO32-
C.H£ę°ĘCu2+°Ę°ĘCl£≠°ĘSO42-D.Ag£ę °ĘNa£ę°ĘNO3£≠°ĘCl£≠
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ”√Ō¬Ń–◊į÷√ĹÝ–– Ķ—ťń‹īÔĶĹŌŗ”¶ Ķ—ťńŅĶńĶń «
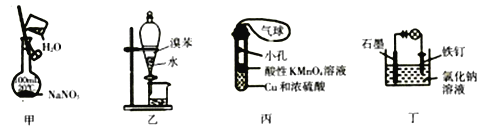
A. ”√ľ◊◊į÷√Ňš÷∆“Ľ∂®őÔ÷ ĶńŃŅŇ®∂»ĶńNaNO3»‹“ļ
B. ”√““◊į÷√∑÷ņŽšŚĪĹļÕňģ
C. ”√ĪŻ◊į÷√÷∆»°SO2∆ÝŐŚ≤Ę—ť÷§∆šĽĻ‘≠–‘(Ņ…ľ”»»)
D. ”√∂°◊į÷√∑ņ÷ĻŐķ∂§…ķ–‚
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥ő¬∂»Ō¬£¨∑ī”¶H2£®g£©+CO2£®g£©H2O£®g£©+CO£®g£©Ķń∆Ĺļ‚≥£ żK= ![]() £ģł√ő¬∂»Ō¬‘ŕŐŚĽżĺýő™10LĶń»żłŲ√‹Ī’»›∆ų÷–∑÷Īūľ”»Ž∑ī”¶őÔ£¨∆ū ľľ”»ŽŃŅ»ÁÕľňý ĺ£ļŌ¬Ń–Ň–∂Ō≤Ľ’ż»∑Ķń «£®°°°°£©
£ģł√ő¬∂»Ō¬‘ŕŐŚĽżĺýő™10LĶń»żłŲ√‹Ī’»›∆ų÷–∑÷Īūľ”»Ž∑ī”¶őÔ£¨∆ū ľľ”»ŽŃŅ»ÁÕľňý ĺ£ļŌ¬Ń–Ň–∂Ō≤Ľ’ż»∑Ķń «£®°°°°£©
∆ū ľŃŅ | ľ◊ | ““ | ĪŻ |
H2 £®mol£© | 1 | 2 | 2 |
CO2£®mol£© | 1 | 1 | 2 |
A.∑ī”¶Ņ™ ľ Ī£¨ľ◊÷–Ķń∑ī”¶ňŔ¬ ◊Ó¬ż£¨ĪŻ÷–Ķń∑ī”¶ňŔ¬ ◊ÓŅž
B.∆Ĺļ‚ Ī£¨ľ◊ļÕĪŻ÷–CO2Ķń◊™ĽĮ¬ ŌŗĶ»£¨ĺý «60%
C.∆Ĺļ‚ Ī£¨““÷–H2Ķń◊™ĽĮ¬ īů”ŕ60%
D.∆Ĺļ‚ Ī£¨ĪŻ÷–c£®H2£© «0.08 molL©Ā1
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com