
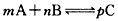 的反应中,经过10 s的反应后,各物质的浓度变化为:A减少a mol/L,B减少a/2
的反应中,经过10 s的反应后,各物质的浓度变化为:A减少a mol/L,B减少a/2 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
|
|
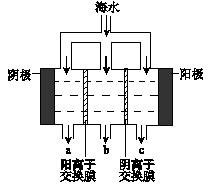
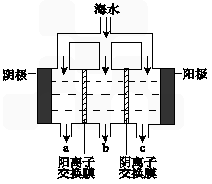
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
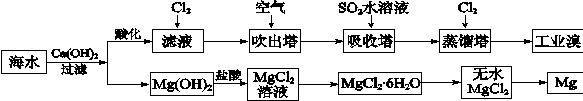
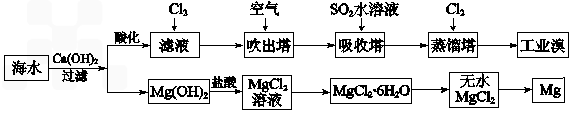
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
查看答案和解析>>
科目:高中化学 来源:2012届北京市西城区高三上学期期末考试化学试卷 题型:填空题
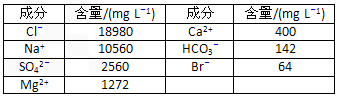
(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市西城区高三上学期期末考试化学试卷 题型:填空题
(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
|
成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Br- |
64 |
|
Mg2+ |
1272 |
|
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com