
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | R与Q的电子数相差18 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | 最高价氧化物对应水化物的酸性:T>Q |
分析 R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,由元素R、X、T、Z、Q在元素周期表中的相对位置,可知T为Cl、Q为Br、X为S、Z为Ar.
A.同一周期元素非金属性随着原子序数增大而增强,稀有气体性质稳定;
B.原子序数相差第三周期、第四周期容纳元素种数;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.非金属性越强,最高价氧化物对应水化物的酸性越强.
解答 解:R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,由元素R、X、T、Z、Q在元素周期表中的相对位置可知,T为Cl、Q为Br、X为S、Z为Ar,
A.同周期随原子序数增大,主族元素非金属性增强,Z为稀有气体Ar,化学性质稳定,故非金属性Ar<S<Cl,故A错误;
B.R为F、Q为Br,二者原子核外电子数相差8+18=26,故B错误;
C.同主族自上而下非金属性减弱,氢化物稳定性减弱,故C错误;
D.非金属性T>Q,故最高价氧化物的水化物的酸性:T>Q,故D正确;
故选D.
点评 本题考查元素周期表与元素周期律应用,难度不大,注意对元素周期律的理解掌握,理解同主族原子序数关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
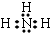 ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.
,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | 只有④ | D. | 全部不是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ④②⑤①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 亚硫酸钠(aq) | D. | 硝酸钾(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

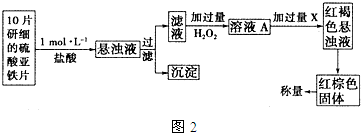
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com