
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mo | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.容器②中达平衡时放出的热量Q=23.15 kJ
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.平衡时,两个容器中NH3的体积分数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:实验题
某学生为测定未知浓度的硫酸溶液(已知滴定时供选择的指示剂有石蕊、酚酞),实验如下:用1.00m L待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
L待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是 。
②该滴定操作中应选用的指示剂是 。
③在G操 作中如何确定终点? 。
作中如何确定终点? 。
(2)酸式滴定管用蒸馏水润洗后,未用待测液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (填“甲”或“乙”)中。
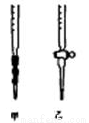
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)。
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 (计算 结果到小数点后二位)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
决定化学反应速率的主要因素是( )
A.反应物的浓度 B.反应温度
B.反应温度
C.使用催化剂 D.反应物的性质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:填空题
化学计量在化学中占有重要地位,请回答下列问题。
(1) 0.3molNH3分子中所含原子数与 个H2O分子中所含原子数相等。
(2)含0.4mol Al3+的Al2(SO4) 3中所含的SO42-的物质的量是 。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 。
(4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是 。
(5)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和CI-的物质的量浓度依次为:0.2moI·L-l、0.25mol·L-l、0.4mol·L-l,则c (S O42-)= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B. O2比O3的质量小
C.两种气体的氧原子数目相等 D.两种气体的分子数目相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
在研究钠的性质时:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。本实验采用的研究方法是( )
①假说法 ②实验法 ③分类法 ④比较法
A.①②③④ B.①③ C.②④ D.①②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol·L-1
B.P点(两曲线交点)时恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
对于合成氨反应N2(g)+3H2(g) 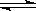 2NH3(g)△H=-92 kJ/mol,下列说法正确的是( )
2NH3(g)△H=-92 kJ/mol,下列说法正确的是( )
A.若起始加入2molN2和6molH2发生反应,则平衡时N2和H2的转化率相同
B.该反应采用高温条件,有利于提高NH3的产率,从而提高生产效率
C. 若起始加入2molN2和6molH2发生反应,平衡时共放热46kJ,则N2的平衡转化率为50%
D.若平衡时保持其它条件不变,压缩容器体积,则平衡正向移动,N2的浓度减小,NH3的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com