
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
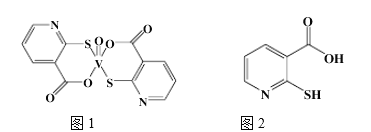
①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
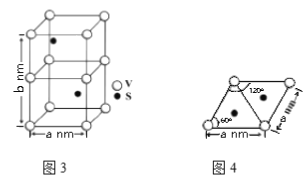
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
【答案】 ![]() +5 正四面体 2 sp3 N>O>C 2-巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大 AD VS
+5 正四面体 2 sp3 N>O>C 2-巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大 AD VS ![]()
【解析】(1)钒原子为23号元素,电子排布式为[Ar]3d34s2,所以外围电子轨道排布式为![]() 。其最稳定的化合价应该是+5,即失去所有的价电子,形成最外层8电子的稳定结构。根据价层电子对互斥原理,VO43-中的中心原子V的价电子为5,配位原子O不提供电子,带有三个单位负电,所以外层电子为8个,共4对,空间构型为正四面体。
。其最稳定的化合价应该是+5,即失去所有的价电子,形成最外层8电子的稳定结构。根据价层电子对互斥原理,VO43-中的中心原子V的价电子为5,配位原子O不提供电子,带有三个单位负电,所以外层电子为8个,共4对,空间构型为正四面体。
(2)①S原子的电子排布为[Ne]3s23p4,所以S原子的3p能级上有4个电子,分配在三个轨道中,有两个单电子。从图中得到S的配位数为2,所以此时S的外层有6+2=8个电子,电子对为4,所以S应该的杂化方式是sp3杂化。其中含有的第二周期元素是C、N、O。同周期元素从左向右应该是第一电离能增大,因为N的2p能级上有3个电子,是p能级的半满稳定结构,所以N的第一电离能反常增大,所以第一电离能为:N>O>C。
②2-巯基烟酸有羧基可以与水分子形成氢键,所以其水溶性会更好。
(3)从题目表述来看,形成离域Π键的要求是:①原子共平面;②有相互平行的p轨道。根据价层电子对互斥理论,二氧化硫为平面三角形,硫酸根为正四面体,硫化氢为角型,二硫化碳为直线型。所以选项B一定错误。而硫化氢的H原子不存在p轨道。所以选项C错误。由上正确的是选项A和选项D。
(4)晶胞中有V为:8×1/8+4×1/4=2个;S为:2×1=2个,所以化学式为VS。因为该晶胞中有2个VS,所以晶胞质量为2×(32+51)/NA g。根据图4得到晶胞底面的面积为a×![]() nm2,所以晶胞的体积为:a×
nm2,所以晶胞的体积为:a×![]() ×b nm3。1nm=10-7cm,所以晶体密度为
×b nm3。1nm=10-7cm,所以晶体密度为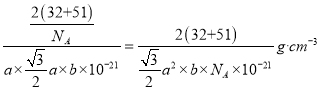 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图为某有机化合物的结构简式:
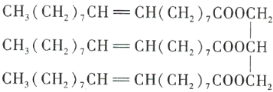
请回答下列问题。
(1)该有机化合物含有的官能团有_______________(填名称)。
(2)该有机化合物的类别是_______________(填字母序号,下同)。
A.烯烃 B.酯 C.油脂 D.羧酸
(3)将该有机化合物加入水中,则该有机化合物_______________。
A.与水互溶 B.不溶于水,水在上层 C.不溶于水,水在下层
(4)该物质是否有固定熔点、沸点?_______________(填“是”或“否”)
(5)能与该有机化合物反应的物质有_______________。
A.![]() 溶液 B.碘水 C.乙醇 D.乙酸 E.
溶液 B.碘水 C.乙醇 D.乙酸 E.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。按要求回答:
![]() 碳原子核外有________种不同空间运动状态的电子
碳原子核外有________种不同空间运动状态的电子
![]() 碳元素能形成多种无机物。石墨与钾可形成石墨夹层离子晶体
碳元素能形成多种无机物。石墨与钾可形成石墨夹层离子晶体![]() 如图
如图![]() ,其结构为每隔一层碳原子插入一层钾原子,与钾原子层相邻的上下两层碳原子排列方式相同,则与钾最近等距的配位碳原子有_________个。
,其结构为每隔一层碳原子插入一层钾原子,与钾原子层相邻的上下两层碳原子排列方式相同,则与钾最近等距的配位碳原子有_________个。
![]() 碳也可形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
碳也可形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。![]() 吡啶分子中含有
吡啶分子中含有![]() 键数目是__________。
键数目是__________。
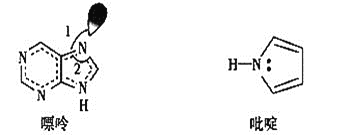
![]() 嘌呤结构中N原子的杂化方式为________。
嘌呤结构中N原子的杂化方式为________。
![]() 嘌呤中轨道之间的夹角
嘌呤中轨道之间的夹角![]() 比
比![]() 大,解释原因___________。
大,解释原因___________。
![]() 将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构
将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构![]() 碳。已知
碳。已知![]() 碳密度为
碳密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则
,则![]() 碳的晶胞参数
碳的晶胞参数![]() ________
________![]() 写出表达式即可
写出表达式即可![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
![]() 、
、![]() 常用作锂离子电池的正极材料。
常用作锂离子电池的正极材料。![]() 的空间构型为____________基态Co原子核外电子排布式为____________,第四电离能
的空间构型为____________基态Co原子核外电子排布式为____________,第四电离能![]() ______
______![]() 填“
填“![]() ”或
”或![]() ”
”![]() ,原因是________________。
,原因是________________。
![]() 铁系元素能与CO形成
铁系元素能与CO形成![]() 、
、![]() 等金属羰基配合物。
等金属羰基配合物。![]() 中与Fe形成配位键的是______
中与Fe形成配位键的是______![]() 填“碳”或“氧”
填“碳”或“氧”![]() 原子。与CO互为等电子体的是_________
原子。与CO互为等电子体的是_________![]() 任写一种即可
任写一种即可![]() 。在CO分子中,
。在CO分子中,![]() 键与
键与![]() 键数目之比为________。
键数目之比为________。
![]() 铁与
铁与![]() 、
、![]()
![]() 环戊二烯
环戊二烯![]() 在隔绝空气条件下共热可制得二茂铁
在隔绝空气条件下共热可制得二茂铁![]() 。在环戊二烯中,C原子的杂化轨道类型为______。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华,则它的晶体类型是___________。
。在环戊二烯中,C原子的杂化轨道类型为______。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华,则它的晶体类型是___________。
![]() 铁单质的堆积方式有两种,其中一种剖面图如图所示:
铁单质的堆积方式有两种,其中一种剖面图如图所示:
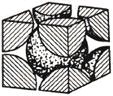
在此堆积方式里,铁原子的半径为![]() ,则其晶胞棱长为_______________cm。
,则其晶胞棱长为_______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu及化合物在生产、国防中有重要的应用。
I.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:Cu2O(s)+![]() O2(g)=2CuO(s) ΔH=-196kJ·mol-1
O2(g)=2CuO(s) ΔH=-196kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220.8kJ·mol-1
则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为___。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
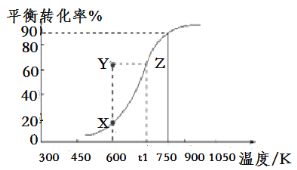
①该反应的ΔH___0(填“>”或“<”);600K时,Y点甲醇的v(正)___v(逆)(填“>”或“<”)。
②在t1K时,向固定体积为1L的密闭容器中充入2molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)___,温度为t1时,该反应的平衡常数K的表达式为___。
II.Cu既是常见的催化剂,又是常见的电极材料。
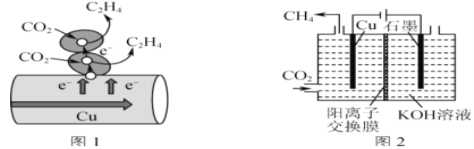
(3)图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当直接传递的电子物质的量为2mol时,则参加反应的CO2的物质的量为___。
(4)图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为___。
III.含铜离子的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
(5)已知:Ksp(CuS)=1×10-36,要使铜离子的浓度符合排放标准(不超过6.25×10-6mol/L),溶液中的硫离子的物质的量浓度至少为___mol/L(保留至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫代硫酸钠在酸性条件下会发生反应:![]() ,下表中的两种溶液混合,出现浑浊的先后顺序是( )
,下表中的两种溶液混合,出现浑浊的先后顺序是( )
组号 | 两种溶液的温度 |
| 稀硫酸的体积、浓度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国航天航空事业蒸蒸日上,航天航空的关键技术是火箭,火箭燃料有液氢、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。请回答下列问题:
等。请回答下列问题:
(1)已知肼的结构简式可表示为![]() 。
。
①肼分子中的化学键类型为 _______________________。
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、_______________________,新形成的化学键有_______________________ 。
③根据肼燃烧过程中的能量变化,说明反应物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是_______________________ 。
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应![]() ,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比一定是1:2
C.达到平衡状态时A的物质的量为![]()
D.当![]() 时,可断定反应达到平衡状态
时,可断定反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com