
����Ŀ����4mol A�����2mol B������2L���ܱ������л�ϣ�����һ�������·������·�Ӧ��2A��g��+B��g��2C��g������Ӧ2s����C��Ũ��Ϊ0.6mol/L������˵����ȷ���ǣ� ��
A.������A��ʾ2 s�ڵ�ƽ����Ӧ����Ϊ0.3 mol/��Ls��
B.������B��ʾ2 s�ڵ�ƽ����Ӧ����Ϊ0.6 mol/��Ls��
C.2 s������A��ת����Ϊ70%
D.2 s������B��Ũ��Ϊ0.35 mol/L
���𰸡�A
���������⣺��Ӧ2s����C��Ũ��Ϊ0.6mol/L�����ʵ���=0.6mol/L��2L=1.2mol��
2A��g�� | + | B��g�� | 2C��g�� | ||
��ʼ����mol�� | 4 | 2 | 0 | ||
�仯����mol�� | 1.2 | 0.6 | 1.2 | ||
2sĩ����mol�� | 2.8 | 1.4 | 1.2 |
A��������A��ʾ2 s�ڵ�ƽ����Ӧ����= ![]() =0.3 mol/��Ls������A��ȷ��
=0.3 mol/��Ls������A��ȷ��
B��������B��ʾ2 s�ڵ�ƽ����Ӧ����= ![]() =0.15 mol/��Ls����B����
=0.15 mol/��Ls����B����
C��2 s������A��ת����= ![]() ��100%=30%����C����
��100%=30%����C����
D��2 s������B��Ũ��= ![]() =0.7mol/L����D����
=0.7mol/L����D����
��ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Bodensteins�о������з�Ӧ��2HI(g)![]() H2(g)+I2(g) H=+11 kJ��mol-1����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
H2(g)+I2(g) H=+11 kJ��mol-1����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
������ʵ�����ݼ���õ�v����x(HI)��v����x(H2)�Ĺ�ϵ������ͼ��ʾ�����ı��������ٴδﵽƽ��ʱ�������й���������ȷ����
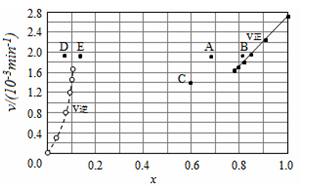
A���������¶ȵ�ijһ�¶ȣ��ٴδﵽƽ��ʱ����Ӧ����ֱܷ���A��E
B�����ٴγ���a mol HI����ﵽƽ��ʱ����Ӧ��ĺ�����ֵ���䣬������ֵ����
C�����ı������������ѹǿ���ٴδﵽƽ��ʱ����Ӧ����ı�����ǰ��ͬ
D�����ı��������ʹ�ô������ٴδﵽƽ��ʱ����Ӧ����ı�����ǰ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�У���pHֵΪ0�������0.lmol/L�������0.01mol/L������������Һ����pHֵΪ11������������Һ����ˮ�������ɵ�c(H+)֮������Ϊ
A. 0��1�� 12��11 B. 14��13��12��11
C. 14��13��2��3 D. 1��10��100��1000
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ5.48gNa2CO3��NaHCO3�Ļ��������ˮ���200mL��Һ������Һ�ֳ����ȷݡ�
��1��������һ����Һ�м���300mLBa(OH)2��Һʱ��ǡ��ʹ���ɰ�ɫ����������࣬��÷�Ӧ����Һ��c(OH-)=0.100mol/L�������Һ����ı���Բ��ƣ���
�ٷ�����Ӧ�����ӷ���ʽΪ_______________��
��n(Na2CO3)��______mol��n(NaHCO3)=______mol��
��2������һ����Һ�л����μ�0.100mol/L���ᣬ�뽫����������̼������������״�����Ҳ�����CO2��ˮ�е��ܽ⣩��μ����������仯��������������ϵ�С�______

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol CO �� 1mol CO2 ������ͬ��
�� ������ �� ԭ������ �� Cԭ���� �� Oԭ����
A. �٢� B. �ڢ� C. �٢� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ӵ�����ʵ��ʱ����������ˮ���뱽����Һ�У����û�з�������������˼����һ�£��ּ������������²�������������˰�ɫ����������Ϊ��ͬѧ�����������������(����)
A. ������Һ�е���������������������Һ
B. ������Һ�е������Ҵ�
C. ������Һ�е����˹����ı�����Һ
D. ������Һ�е����˹�����Ũ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ��Ũ��ˮ��ȥ���еı���
B. �ú˴Ź���������1��������2������
C. ������������Һմ��Ƥ���ϣ�������ϡNaOH��Һ��ϴ
D. ��������KMnO4��Һ��������÷ֲ㣬�²�Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��λ�ڶ����ڵ�����Ԫ�أ���֪�������ȶ��ԣ�HmD��HmC����Cm����E��m��1���� ������ͬ�ĵ��Ӳ�ṹ����A��B��ͬһ���ڣ��ڸ�������������Ԫ���У�A��ԭ�Ӱ뾶���B�����Ӱ뾶��С����A��B������֮����D��������3��������������Ϣ����Ӧ�Ļ�ѧ����ش��������⣺
��1���õ���ʽ��ʾAmC���γɹ��� ��
��2��Cm����E��m��1�����Ļ�ԭ��ǿ��˳��Ϊ�� �� �������ӷ��ű�ʾ����֤���仹ԭ��ǿ�������ӷ���ʽΪ ��
��3����E�ĵ���ͨ��A��D�γɵĻ������ˮ��Һ�У��ڳ����·�Ӧ�����ӷ���ʽΪ�� ��
��4�������£��������ʵ���Ũ�ȵ�HmC��Һ��A������������Ӧ��ˮ������Һ�������1��1��ϣ�д���÷�Ӧ�����ӷ���ʽ �� ����Һ�����ʺ��еĻ�ѧ�������� ��
��5��HmD�� HmC�е�ϸߵ������ѧʽ����ԭ���� ��
��6����A��B��C��E�����У���������ת����ϵ��������Ԫ�ط��ţ��� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��뷽���в���ȷ����
A��������ȡ���������Ȼ�̼��ȡ��ˮ�е��嵥��
B����������ķ������Է���е����ϴ��Һ������
C�����ýᾧ�ķ�����ȥKNO3�е��Ȼ���
D�����÷�Һ�ķ�������ƾ���ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com