
| A. | $\frac{a}{576v}$mol/L | B. | $\frac{125a}{36v}$mol/L | C. | $\frac{250a}{36v}$mol/L | D. | $\frac{250a}{48v}$mol/L |
分析 根据n=$\frac{m}{M}$计算出硫酸根离子的物质的量,从而可计算出0.5L溶液中含有的硫酸根离子,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中铁离子的物质的量,最后根据c=$\frac{n}{V}$计算出稀释后溶液中Fe3+的物质的量的浓度.
解答 解:ag硫酸根离子的物质的量为:$\frac{ag}{96g/mol}$=$\frac{a}{96}$mol,取出的0.5VL溶液中含有硫酸根离子的物质的量为:$\frac{a}{96}$mol×$\frac{0.5VL}{VL}$=$\frac{a}{192}$mol,
稀释过程中溶质的物质的量不变,则稀释后溶液中铁离子物质的量为:$\frac{a}{192}$mol×$\frac{2}{3}$=$\frac{a}{288}$mol,
则稀释后溶液中铁离子浓度为:$\frac{\frac{a}{288}mol}{2VL}$$\frac{a}{576}$mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
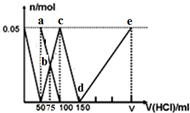
| A. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol•L-1 | |
| D. | d→e的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
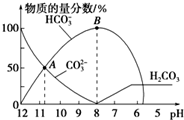
| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是Na+ | |
| C. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| D. | 25℃时,CO32-水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6 | B. | C2H4 | C. | C4H6 | D. | C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com