
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
| ����a | ��̿���ڸ��������»�ԭCuO |
| ����b | �������ǻ�ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O�� |
| ����c | ��ⷨ����ӦΪ2Cu + H2O |
| ����d | ���£�N2H4����ԭ���Ƶ�Cu(OH)2 |
��1����֪��2Cu��s����1/2O2(g)=Cu2O��s������H = -169kJ��mol-1
C��s����1/2O2(g)=CO(g)����H = -110.5kJ��mol-1
 Cu��s����1/2O2(g)=CuO��s������H = -157kJ��mol-1
Cu��s����1/2O2(g)=CuO��s������H = -157kJ��mol-1
��a�������Ȼ�ѧ����ʽ�ǣ� __ �� ___
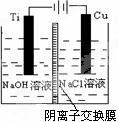
��2������c�������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ����� Cu2O��װ������ͼ��ʾ���õ�ص�������ӦʽΪ __ �� ___
�Ѽ�������pHֵ __ �� ___ ������С�����䣩
��3������dΪ������������Һ̬�£�N2H4����ԭ����Cu(OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ �� ___
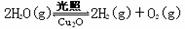 ��4������ͬ���ܱ������У������Ϸ����Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺 ��H>0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
��4������ͬ���ܱ������У������Ϸ����Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺 ��H>0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
| ��� |
| 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
����������ȷ���� __ �� ___ ������ĸ����
A��ʵ����¶ȣ�T2<T1 B��ʵ��ڱ�ʵ������õĴ�����Ч�ʸ�
C��ʵ���ǰ20 min��ƽ����Ӧ���� v(H2)=7��10-5 mol��L-1 min-1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ����K3[Fe(C2O4)3]��3H2O�Ǵ���ɫ���壬��421~553��ʱ���ֽ�ΪFe2O3��K2CO3��CO��CO2��H2O��ʵ�����ɲ����������壨FeC2O4��2H2O��������أ�K2C2O4�������ᣨH2C2O4����˫��ˮ��H2O2������Ʊ���
2FeC2O4��2H2O + H2O2+ 3K2C2O4+ H2C2O4��2K3[Fe(C2O4)3]��3H2O
��1��[Fe(C2O4)3]3����������_______________��
��2���Ʊ�����Ҫ��ֹ���ᱻH2O2������д�����ᱻH2O2�����Ļ�ѧ����ʽ__________��
��3���������ȶ��Կ������ȶ�����K����������Cu2+ + 4NH3 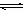 [Cu(NH3)4]2+�����ȶ���������ʽΪ��
[Cu(NH3)4]2+�����ȶ���������ʽΪ��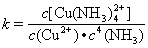 ����֪K [Fe(C2O4)3]3��=1020��K [Fe(SCN)3]= 2��103���ܷ���KSCN��Һ����K3[Fe(C2O4)3]��3H2O�е���Ԫ�أ� ����ǡ��������� ��ѡ��������Ƽ���K3[Fe(C2O4)3]��3H2O����Ԫ�صķ�����__________________________��
����֪K [Fe(C2O4)3]3��=1020��K [Fe(SCN)3]= 2��103���ܷ���KSCN��Һ����K3[Fe(C2O4)3]��3H2O�е���Ԫ�أ� ����ǡ��������� ��ѡ��������Ƽ���K3[Fe(C2O4)3]��3H2O����Ԫ�صķ�����__________________________��
��4����Ԫ�ؿ��γɶ�����������һ����������A���������ʳƷ���Ӽ�������ɷ���A����K��Fe��C��N����Ԫ�ء�ȡ36.8g A������400�棬�ֽ��KCN��Fe3C��C��N2�����ɵĵ����ۺϳɱ�״���µ����Ϊ2.24L��Fe3C������C������3����Fe3C���ʵ����ǵ������ʵ�����1/3����A�Ļ�ѧʽΪ____________________��
|
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���������ָ����Һ��һ���ܴ����������
A��ʹ���ȱ��ɫ����Һ��Mg2+��K+��SO42-��NO3��
B��PH=13����Һ��Na+��Cu2+��HCO3-��NO3��-
C��ˮ�������c(H+)=10��12mol/L����Һ��K+��Na+��CO32-��Br-
D��0.1mol/L��AgNO3����Һ��H+��K+��SO42-��I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������µ�pH��������Ĵ��������������Һ�ֱ��ȡ���д�ʩ���й�������ȷ����
A���������Ĵ����ƾ��������Һ��pH������
B�������������մ�����ַ�Ӧ������Һ�в�����CO2һ����
C����ˮϡ��2��������Һ��pH����С
D����������п��ַ�Ӧ�������в������������ʿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����H++OH��==H2O��ʾ�ķ�Ӧ�ǣ� ����
A��Ba(OH)2��Һ��H2SO4��Һ��Ӧ B��Cu(OH)2��ϡHNO3��Ӧ
C��KOH��ϡH2SO4��Ӧ D��NaOH�������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�����ŷŵĹ�ҵ��ˮ�п��ܺ���K+��Ag+��NH4+��Mg2+��SO42����Cl����NO3����
����HCO3�������ӡ�������ˮ�����Եļ��ԣ����ȷ���ó���ˮ�п϶������е���������ǣ��� ��
��������Ag+��K+��NO3����HCO3�������� ������ �£�K+��NH4+��NO3����SO42��
�����ã�Ag+��NH4+��Mg2+��HCO3���� ���� ���� �ģ�K+��Mg2+��SO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ��Na2O2��SO2===Na2SO4��Ƚϣ�Na2O2��������ͬ����
A��2Na2O2��2CO2===2Na2CO3��O2�� B��2Na2O2��2SO3===2Na2SO4��O2��
C��Na2O2��H2SO4=== Na2SO4��H2O2 D��3Na2O2��Cr2O3===2Na2CrO4��Na2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������66������������������������ɡ������˿���֯�����������·�ߺϳɣ�
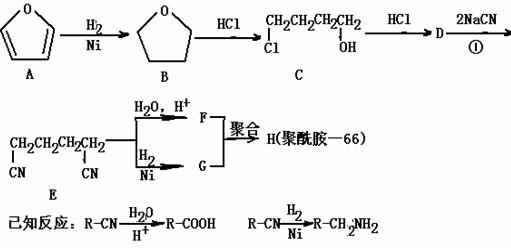
��1������������Һ��Ӧ��B��ͬ���칹��Ľṹ��ʽΪ
��2�� D�Ľṹ��ʽΪ ���ٵķ�Ӧ����Ϊ
D�Ľṹ��ʽΪ ���ٵķ�Ӧ����Ϊ
��3��Ϊ����D�еĹ����ţ������Լ�����NaOHˮ��Һ��
��4����F��G����H�ķ�Ӧ����ʽΪ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com