
(1)硝酸钡、氯化钙、碳酸钾
(2)①Ba(NO3)2+K2CO3==BaCO3↓+2KNO3 CaCl2+K2CO3==CaCO3↓+2KCl
②BaCO3+2HNO3==Ba(NO3)2+CO2↑+H2O CaCO3+2HNO3==Ca(NO3)2+CO2↑+H2O
③Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
④KCl+AgNO3==KNO3+AgCl↓
【解析】本题考查物质的检验。由题中实验的明显实验现象,由①②可推知一定含有K2CO3,Ba(NO3)2、
CaCl2中至少含有一种;由③可推知②的溶液中含有Ba2+,证明原物质含有Ba(NO3)2;由④可推知②的溶液中含有Cl―,证明原物质含有CaCl2,由明显的现象推断出某离子后,还应分析这种离子是原物质中的,还是加入新试剂带入的。


科目:高中化学 来源: 题型:
在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数可表示为 ( )
A.wx mol-1 B.22.4x mol-1 C.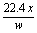 mol-1 D.
mol-1 D.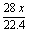 mol-1
mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组溶液:①汽油和氯化钠溶液 ②75%的乙醇溶液 ③氯化钠和单质溴的水溶液(分离出溴单质),分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
配制250 mL 0.10 mol·L―1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度,再补充几滴水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
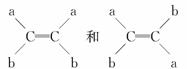
已知(a、b分别代表不同的原子或原子团)互为同分异构体。 据此推断一氯丙烯的同分异构体 (不含环状结构)共有
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C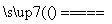 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2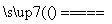 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1) 写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN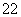 ,与CN
,与CN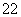 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN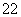 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(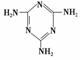 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (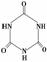 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
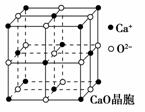 (4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ,
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:
CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能
差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
 Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是: __ ▲ ___
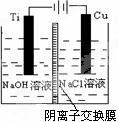
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米 Cu2O,装置如右图所示:该电池的阳极反应式为 __ ▲ ___
钛极附近的pH值 __ ▲ ___ (增大、减小、不变)
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ ___
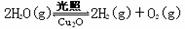 (4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: △H>0。水蒸气的浓度随时间t变化如下表所示。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: △H>0。水蒸气的浓度随时间t变化如下表所示。
| 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 __ ▲ ___ (填字母)。
A.实验的温度:T2<T1 B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com