
可以由下列反应合成三聚氰胺:CaO+3C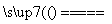 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2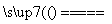 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1) 写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN ,与CN
,与CN 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN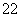 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(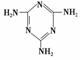 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (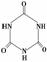 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
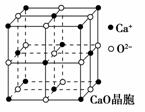 (4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ,
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:
CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能
差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
科目:高中化学 来源: 题型:
在0℃和1.01×105 Pa条件下,将0.1 g H2、3.2 g SO2、2.2 g CO2混合,该混合气的体积是
A.2.24 L B.3.36 L
C.4.48 L D.6.72 L
查看答案和解析>>
科目:高中化学 来源: 题型:
试设计一个方案,在用廉价的原料和每种原料只用一次的条件下,分三步从含有Fe3+、Cu2+、Cl-、NO3-的废液中,把Fe3+转化为绿矾回收;把Cu2+转化为Cu回收。各步反应应加入的原料依次是________、________、________。各步反应的离子方程式是:
(1)________________;
(2)________________;
(3)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,
加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c (H+)=10-13mol/L
B.所得溶液中由水电离产生的c (OH-)=10-13 mol/L
C.所加的烧碱溶液的pH=13.0
D.所得溶液中的c (Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对过氧化钙的叙述错误的是
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2和水反应时,每产生1 mol O2转移电子2 mol
C.CaO2中阴阳离子的个数比为2∶1
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2 =2Ca CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Al3+、NH4+的溶液中,加入足量Na2O2固体,微热充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A.Fe3+ B.Al3+ C.NH4+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备:
2FeC2O4·2H2O + H2O2+ 3K2C2O4+ H2C2O4=2K3[Fe(C2O4)3]·3H2O
(1)[Fe(C2O4)3]3-的名称是_______________。
(2)制备过程要防止草酸被H2O2氧化,写出草酸被H2O2氧化的化学方程式__________。
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3 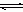 [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为: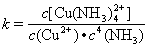 。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
(4)铁元素可形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂。经组成分析A仅含K、Fe、C、N四种元素。取36.8g A加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍,Fe3C物质的量是氮气物质的量的1/3。则A的化学式为____________________。
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排放的工业废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、
HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A.Ag+、K+、NO3-、HCO3- B.K+、NH4+、NO3-、SO42-
C.Ag+、NH4+、Mg2+、HCO3- D.K+、Mg2+、SO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com