
在0℃和1.01×105 Pa条件下,将0.1 g H2、3.2 g SO2、2.2 g CO2混合,该混合气的体积是
A.2.24 L B.3.36 L
C.4.48 L D.6.72 L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是________(填序号)。
A.铜的熔点不是太高,易于冶炼铸造成型 B.铜的性质不活泼,不易被腐蚀
C.我国较早掌握了湿法冶炼铜的技术 D.自然界有大量游离态的铜
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是________(填名称),铁的氧化物常见的还有________(填化学式)。
(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用。但是该氧化膜易被酸、碱破坏,若用铝制品盛放氢氧化钠溶液,发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数可表示为 ( )
A.wx mol-1 B.22.4x mol-1 C.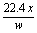 mol-1 D.
mol-1 D.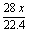 mol-1
mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,m g气体A与n g气体B的分子数相同,下列说法不正确的是( )
A.气体A与B的相对分子质量之比为m∶n
B.同质量的气体A与B的分子数之比为n∶m
C.同温同压下,气体A与B的密度之比为n∶m
D.相同状况下,同体积的A与B的质量之比为n∶m
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为
XY2 (1)+3O2 (g)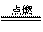 XO2 (g)+2YO2 (g)
XO2 (g)+2YO2 (g)
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)反应前O2的体积是________。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素质量比是3∶16,则X、Y两元素分别为________和________(填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C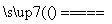 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2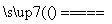 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1) 写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN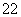 ,与CN
,与CN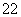 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN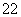 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(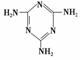 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (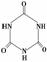 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
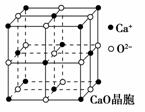 (4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ,
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:
CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能
差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com