
氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:
下列有关该反应的叙述正确的是
A.正反应活化能小于169.8kJ·mol-1
B.逆反应活化能一定小于169.8kJ·mol-1
C.正反应活化能不小于169.8kJ·mol-1
D.正反应活化能比逆反应活化能小169.8kJ·mol-1
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示。在4000℃~5000℃时可能发生下列哪些反应 (填写字母)。


(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。该电解装置中电解排出液中的主要成分是 (写化学式)。
(5)已知下列物质的KSP:
5.6×10-12;Ca(OH)2;1.4×10-5。氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42— [c(SO42—)>c(Ca2+)]。某精制流程如下:

①盐泥a除泥沙外,还含有的物质是 。
②过程I中将NH4+转化为N2的离子方程式是 。
③过程II中除去的离子有 。
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L。若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液 kg(溶液体积变化忽略不计)
(15分,第(1) 1分,其余每空2分)
(1)C (2)为H2S热分解反应提供热量
(3)ABC (只写BC给1分,其它答案不给分)
(4)K2CO3或K2CO3和KOH(只答KOH不给分)
(5)①Mg(OH)2
②2NH4++3Cl2+8OH-
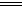 N2↑+6Cl-+8H2O
N2↑+6Cl-+8H2O
③SO42-、Ca2+ ④1.26
【解析】
试题分析:
(1)△H>0说明正反应吸热,正反应活化能大于或等于169.8kJ,C正确;A、B错误;正反应活化能比逆反应活化能大169.8kJ,D错误。
(2)硫化氢分解需吸收热量,通入空气使部分硫化氢燃烧以提供硫化氢分解所需热量。
(3)A、B分别为H、O原子,所以4000℃~5000℃时A、B、C三个反应均能发生。
(4)阴极反应为2H2O+2e-=H2↑+2OH-,阳极产生了氮气,尿素中N为-3价,所以阳极同时生成二氧化碳,二氧化碳与KOH生成碳酸钾。电解排出液中的主要成分是碳酸钾或碳酸钾和氢氧化钾。
(5)①当pH=11时,溶液中c(Mg2+)=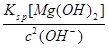 =5.6×10-6<10-5;Mg2+沉淀完全,所以盐泥a中含有氢氧化镁。②氯气碱性条件下将NH4+氧化生成N2,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平。③BaCO3(s)
=5.6×10-6<10-5;Mg2+沉淀完全,所以盐泥a中含有氢氧化镁。②氯气碱性条件下将NH4+氧化生成N2,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平。③BaCO3(s)  Ba2+(aq)+CO32-(aq),SO42-与Ba2+、CO32-与Ca2+形成更难溶的硫酸钡和碳酸钙,所以过程II加入碳酸钡除去Ca2+和SO42-。④过程III加入亚硫酸钠溶液还原溶液的ClO-,由得失电子相等得n(ClO-)=n(SO32-),
Ba2+(aq)+CO32-(aq),SO42-与Ba2+、CO32-与Ca2+形成更难溶的硫酸钡和碳酸钙,所以过程II加入碳酸钡除去Ca2+和SO42-。④过程III加入亚硫酸钠溶液还原溶液的ClO-,由得失电子相等得n(ClO-)=n(SO32-),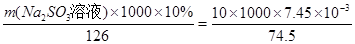 ,m(Na2SO3溶液)=1.26kg。
,m(Na2SO3溶液)=1.26kg。
考点: 化学反应与能量 活化能 图像的分析 电化学 溶度积 离子方程式 氧化还原反应 化学计算


科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.| 储氢 | 释氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com