



 CH3OH(g)+H2O(g) ��H =��49 kJ��mol-1(3��))��bd (2�֣���ѡ��ѡ0�֣�©ѡ1����1��)
CH3OH(g)+H2O(g) ��H =��49 kJ��mol-1(3��))��bd (2�֣���ѡ��ѡ0�֣�©ѡ1����1��) (2��)
(2��)  CH3OH(g)+H2O(g) ��H =��49 kJ��mol-1
CH3OH(g)+H2O(g) ��H =��49 kJ��mol-1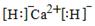 ��
��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CO2(g)+ N2(g) ��H��0��
2CO2(g)+ N2(g) ��H��0��
 N2O4(g) ��H����56.9 kJ/mol ��
N2O4(g) ��H����56.9 kJ/mol �� 2N2(g) + 3H2O(g)��
2N2(g) + 3H2O(g)��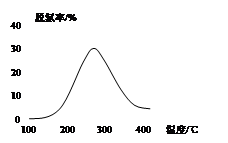

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ܢ� | B���٢ڢ� | C���٢ڢ� | D���ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ȼ����Ϊ 890 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)=CO2(g)��2H2O(g)����H����890 kJ��mol��1 |
B��500�桢30 MPa�£���0.5 mol N2��1.5 mol H2�����ܱ������г�ַ�Ӧ����NH3(g)������19.3 kJ�����Ȼ�ѧ����ʽΪ��N2(g)��3H2(g) 2NH3(g)����H����38.6 kJ��mol��1 2NH3(g)����H����38.6 kJ��mol��1 |
| C����֪��H2(g)��F2(g)=2HF(g)����H����270 kJ��mol��1����1 mol������1 mol������Ӧ����2 molҺ̬������ų�������С��270 kJ |
| D����C����ͬ�����£�2 mol HF���������С��1 mol������1 mol�����������ܺ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 O2(g)=CO2(g)��H2����283 kJ/mol
O2(g)=CO2(g)��H2����283 kJ/mol O2(g)=CO(g)��H3����
O2(g)=CO(g)��H3����| A��CO��ȼ����Ϊ283 kJ/mol |
| B��������̼�ֽ�Ϊһ����̼�������ķ�Ӧ�����ȷ�Ӧ |
| C����H3����H2����H1��110��5 kJ/mol |
| D����H3����H1����H2����110��5 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����ӦO3��O=2O2�Ħ�H��E1��E3 |
| B����ӦO3��O=2O2�Ħ�H��E2��E3 |
| C��O3��O=2O2�����ȷ�Ӧ |
| D����H����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���õζ���ȡ����ҩƷ |
| B��NaOH��Һ�ڵ���С�ձ�ʱ,���������� |
| C����С�ձ�������ϴ�,�в��ŵ�����ĭ���Ͻ϶� |
| D������HCl��Һ���¶ȼ���ˮϴ�����������NaOH��Һ���¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��C(s)�� O2(g)=CO(g)��H����393.5 kJ��mol��1 O2(g)=CO(g)��H����393.5 kJ��mol��1 |
| B��2H2(g)��O2(g)=2H2O(g)��H����571.6 kJ��mol��1 |
| C��CH4(g)��2O2(g)=CO2(g)��2H2O(g)��H����890.3 kJ��mol��1 |
D�� C6H12O6(s)��3O2(g)=3CO2(g)��3H2O(l)��H����1 400 kJ��mol��1 C6H12O6(s)��3O2(g)=3CO2(g)��3H2O(l)��H����1 400 kJ��mol��1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com