
A.C(s)+ O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
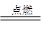 2CO2 2H2+O2
2CO2 2H2+O2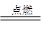 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O| | 乙烷 | 丙烷 | 丁烷 |
| 熔点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Cl2+2H2O
2Cl2+2H2O

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 |
| B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 |
| C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多 |
| D.因为3O2===2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) 放热反应 |
| B.2CO(g)+O2(g)=2CO2(g) 放热反应 |
| C.CaCO3(s)=CaO(s)+CO2 吸热反应 |
| D.H+(aq)+OH-(aq)=H2O(l) 放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com