
����Ŀ������ʱ��ksp(CaC2O4)=2.4��10-9�������й�0.10mol/L������(Na2C2O4)��Һ��˵������ȷ����
A. ��Һ�и�����Ũ�ȴ�С��ϵc(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
B. ������Һ�в��ϼ�ˮϡ�ͣ���Һ�и�����Ũ�Ⱦ���С
C. ����pH�Ʋ�ô���Һ��pH=a����H2C2O4�ĵڶ�������ƽ�ⳣ��ԼΪKa2=1013-2a
D. �������Һ�м�������CaCl2��Һ���ܹ�������������CaCl2��Һ����СŨ��Ӧ�ô���2.4��10-8mol/L
���𰸡�C
��������A. ��Һ��C2O42-+H2O![]() HC2O4-+OH-��H2O
HC2O4-+OH-��H2O![]() H++OH��������Ũ�ȴ�С��ϵc(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)����A����B. ������Һ�в��ϼ�ˮϡ�ͣ���Һ���Լ�����c(OH-)��С��ͬʱc(H+)����B����C. HC2O4-
H++OH��������Ũ�ȴ�С��ϵc(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)����A����B. ������Һ�в��ϼ�ˮϡ�ͣ���Һ���Լ�����c(OH-)��С��ͬʱc(H+)����B����C. HC2O4-![]() H++C2O42-��Ka2=c(H+)c(C2O42-)/c(HC2O4-)��0.10mol/LNa2C2O4��Һ��C2O42-+H2O
H++C2O42-��Ka2=c(H+)c(C2O42-)/c(HC2O4-)��0.10mol/LNa2C2O4��Һ��C2O42-+H2O![]() HC2O4-+OH-��c(HC2O4-)�� c(OH-)��Ka2��c(H+)c(C2O42-)/c(OH-)= (H+)2c(C2O42-)/Kw=1013-2a����C��ȷ��D. �������Һ�м�������CaCl2��Һ���ܹ�����������c(Ca2+)>ksp(CaC2O4)/c(C2O42-)=2.4��10-9/0.10mol/L=2.4��10-8mol/L����CaCl2��Һ����СŨ��Ӧ�ô���2��2.4��10-8mol/L��4.8��10-8mol/L����D����ѡC��
HC2O4-+OH-��c(HC2O4-)�� c(OH-)��Ka2��c(H+)c(C2O42-)/c(OH-)= (H+)2c(C2O42-)/Kw=1013-2a����C��ȷ��D. �������Һ�м�������CaCl2��Һ���ܹ�����������c(Ca2+)>ksp(CaC2O4)/c(C2O42-)=2.4��10-9/0.10mol/L=2.4��10-8mol/L����CaCl2��Һ����СŨ��Ӧ�ô���2��2.4��10-8mol/L��4.8��10-8mol/L����D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ϩ��˵���������( )
A. ������ɺ������ҵ�ʯ�ͻ�����չˮƽB. ����ʹ���Ը��������Һ��ɫ
C. �ڹ�ҵ��������������ϩ����D. ��ũҵ����ֲ���������ڼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�Ũ����ȱ��ֳ�ǿ�������ֱ��ֳ����Ե���( )
A. 2NaCl��H2SO4(Ũ)![]() Na2SO4��2HCl��
Na2SO4��2HCl��
B. Na2SO3��H2SO4(Ũ)![]() Na2SO4��SO2����H2O
Na2SO4��SO2����H2O
C. C��2H2SO4(Ũ)![]() CO2����2SO2����2H2O
CO2����2SO2����2H2O
D. 2FeO��4H2SO4(Ũ)![]() Fe2(SO4)3��SO2����4H2O
Fe2(SO4)3��SO2����4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ķ���ʽΪC18H26O5,1mol������ȫˮ��õ�1mol�����2mol�Ҵ���������ķ���ʽΪ
A. C16H22O5 B. C14H16O4 C. C16H20O4 D. C14H18O5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2��aq��+I����aq��![]() I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
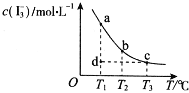
A. ��Ӧ I2��aq��+I����aq��![]() I3����aq����H��0
I3����aq����H��0
B. ���¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K2��K1
C. ��T1ʱ����Ӧ���е�״̬dʱ��һ��������������
D. ״̬a��״̬b��ȣ�״̬bʱI2��ת���ʸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ħ�ݵ������ó�������̫���ܵ�ذ����������е�����ӵ�س�磬��ط�Ӧԭ��ΪLiCoO2 +6C![]() li1-xCoO2 +lixC6���ṹ��ͼ��ʾ������˵����ȷ����
li1-xCoO2 +lixC6���ṹ��ͼ��ʾ������˵����ȷ����
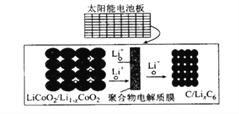
A. �ŵ�ʱ��������������
B. ���ʱ����������������ƶ�
C. �ü����˵�ع���ʱ���漰����������ʽ��3 ��
D. ���ʱ�������ĵ缫��ӦʽΪLi1-xCoO2+xLi++xe-= LiCoO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Co�����仯�����ڹ�ҵ���й㷺Ӧ�á�Ϊ��ij��ҵ�����л�����,ijѧ��������������������к���Al��Li��Co2O3��Fe2O3����������
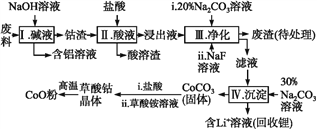
��֪:�������ܽ���:LiF������ˮ,Li2CO3����ˮ;
�ڲ��ֽ��������γ��������������pH���±���
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(��ʼ����) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(��ȫ����) | 3.2 | 9.15 | 1.09 | 4.7 |
��ش�:
��1���������еõ�������Һ�ķ�Ӧ�����ӷ���ʽ��__________��
��2��д����������Co2O3�����ᷴӦ����Cl2�����ӷ���ʽ:______��
��3����������Na2CO3��Һ�������ǵ�����Һ��pH,Ӧʹ��Һ��pH������______;�����е���Ҫ�ɷֳ���LiF��,����______��
��4��NaF����Һ�е�Li+�γ�LiF����,�˷�Ӧ�Բ����������������______��
��5���ڿ����м���5.49 g�����ܾ�����CoC2O4��2H2O����Ʒ,���ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ�������,�����������
�¶ȷ�Χ/�� | ��������/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
�ټ��ȵ�210 ��ʱ,�������������ԭ����__________��
�ھ��ⶨ,���ȵ�210~290 �������е�������ֻ��CO2���ܵ�������span>,�˹��̷�����Ӧ�Ļ�ѧ����ʽΪ___________��[��֪M(CoC2O4��2H2O)=183 g��mol-1]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɺ�ͭ������ͭ��һ�ַ����ǣ�
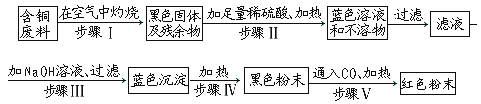
��1��д�����в����еĻ�ѧ����ʽ��������_________������V��_________��
��2�����������γɵ���ɫ��Һ�е�������_________��
��3�����������п�����ɿ�����Ⱦ�IJ�����_________��
��4������ͭ���ϵ�����Ϊaǧ�ˣ���ɫ��ĩ������bǧ�ˣ���ú�ͭ�����еĺ�ͭ��Ϊ��___________���ú�a,b�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25 ��ʱ,����������ʵĵ���ƽ�ⳣ���������±���
���ữѧʽ | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.7��10��5 | 6.2��10��10 | K1��4.3��10��7 K2��5.6��10��11 |
��1�������ӷ���ʽ��ʾNa2CO3��Һ�ʼ��Ե�ԭ��____________________��
��2�������ʵ���Ũ�ȵ�A��CH3COONa B��NaCN C��Na2CO3 D��NaHCO3��Һ��pH�ɴ�С��˳��Ϊ____________________________________(����ĸ)��
��3����֪��25��ʱ, ��HCN��Һ��NaOH��Һ�������Ũ�Ȼ�Ϻ�,����Һ������Ũ���ɴ�С��˳����____________________________________��
��4�������£�0.1mol��L��1��CH3COOH��Һ��ˮϡ�ͣ����б���ʽ�����ݱ�����______��
A��c(H��) B��c(H��)/c(CH3COOH) C��c(H��)��c(OH��)
��5�������Ϊ10 mL ,pH��Ϊ2�Ĵ�����Һ������ֱ�������Zn��Ӧ����Ӧ�տ�ʼʱ����H2�����ʣ�v(HCl)______v(CH3COOH)���������������������ͬ������Ӧ��ȫ������������������m(H2)����_______m(H2)������
���𰸡� CO32-+H2O HCO3-+OH- C>B>D>A c(Na+)>c(CN-)>c(OH-)>c(H+) B = <
����������1��. Na2CO3��ǿ�������Σ�̼������ӷ���ˮ�⣺CO32-+H2O HCO3-+OH-��ʹ��Һ�ʼ��ԣ��ʴ�Ϊ��CO32-+H2O HCO3-+OH-��
��2��.�ɱ������ݿ�֪������ǿ��˳��Ϊ��CH3COOH> H2CO3> HCN>HCO3��������Խ��Խˮ��Ĺ��ɿ�֪�����ӵ�ˮ��̶ȣ�CO32��>CN��>HCO3��>CH3COO����������ʵ���Ũ�ȵ�A��CH3COONa B��NaCN C��Na2CO3 D��NaHCO3������Һ��pH�ɴ�С��˳��Ϊ��C>B>D>A���ʴ�Ϊ��C>B>D>A��
��3��.��25��ʱ����HCN��Һ��NaOH��Һ�������Ũ�Ȼ�Ϻ���ǡ����ȫ��Ӧ���õ�NaCN��Һ����Na����ˮ���CN��ˮ�⣬����c(Na��)��c(CN��)��CN��ˮ��ʹ��Һ�ʼ��ԣ���c(OH-)>c(H+)�����ε�ˮ�ⷴӦ�����ģ���c(CN-)>c(OH-)�����Դ���Һ������Ũ���ɴ�С��˳������c(Na+)>c(CN-)>c(OH-)>c(H+)���ʴ�Ϊ��c(Na+)>c(CN-)>c(OH-)>c(H+)��
��4��.A.�����£�0.1 mol��L��1��CH3COOH ��Һ��ˮϡ�ͣ��ٽ�����ĵ��룬ʹ�������ƽ�������ƶ���n��H+������c��H+����c��CH3COO������С����A����B. ����Ka= ��֪��
��֪�� 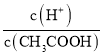 =
= 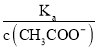 ������A�������֪��c��CH3COO������С�����¶Ȳ��䣬��Ka��������
������A�������֪��c��CH3COO������С�����¶Ȳ��䣬��Ka��������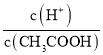 =
= 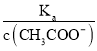 ����B��ȷ��C. c(H��)��c(OH��)= Kw�����¶Ȳ��䣬��Kw��������c(H��)��c(OH��)Ҳ���䣬��C����ѡB��
����B��ȷ��C. c(H��)��c(OH��)= Kw�����¶Ȳ��䣬��Kw��������c(H��)��c(OH��)Ҳ���䣬��C����ѡB��
��5��.pH��ͬ�IJ�ͬ����������У�������Ũ����ͬ����Ӧ�տ�ʼʱ����Zn��Ӧ���ʵ���ͬ������������ᣬ���������Ũ�ȴ���������Ũ�ȣ����������Ũ�ȵ���������Ũ�ȣ����Դ����Ũ�ȴ���HCl��Ũ�ȣ�������������������m��H2������<m��H2���������ʴ�Ϊ��=������
�㾦��������Ҫ����������ʵĵ���ƽ�����Һ����Ũ�ȵĴ�С�Ƚ�����Ŀ�ѶȲ�����������״����ǵ���4��С��������ʱ��Ҫ���ƽ���ƶ�ԭ����ҲҪ��������ƽ�ⳣ��ֻ���¶��йؽ����жϣ���Ƚ�c(H��)/c(CH3COOH)ʱ�����Ը���Ka=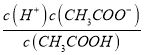 �ó���
�� 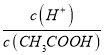 =
= 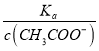 ���ٸ���c��CH3COO������С�����¶Ȳ��䣬��Ka��������
���ٸ���c��CH3COO������С�����¶Ȳ��䣬��Ka��������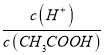 =
= 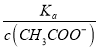 �����Կ��ٽ���������⡣
�����Կ��ٽ���������⡣
�����͡�������
��������
25
����Ŀ����������������ǹ�ҵ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����ﳣ���Ļ�ѧ�Լ���
�ⶨ�к��ȣ�
��1��д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ__________���к�����ֵΪ57.3kJ/mol����
��2��ȡ50mL 0.5mol/L HCl��Һ��50mL0.55mol/L NaOH��Һ���вⶨ����ʵ����ֵС��57.3kJ/mol��ԭ������_______������ţ���
A�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳⶨ������¶�
B����ȡ��������ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D��ʵ��װ�ñ��¡�����Ч����
������к͵ζ���
���ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.1000 mol��L-1 HCl����Һ�����к͵ζ�(�÷�̪��ָʾ��)����ش��������⣺
��1����ʽ�ζ���������ˮϴ��������Ӧ�ý��еIJ�����__________________________��
��2������ѧ����ʵ������У���¼�ζ�ǰ�ζ�����Һ�����Ϊ1.10 mL���ζ���Һ����ͼ�����ʱ���ı���Һ�����Ϊ___________��
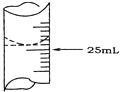
��ѧ����������ƽ��ʵ�飬���ݼ�¼���£�
ʵ����� | ����NaOH��Һ�����/mL | 0.1000mol��L-1HCl��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
��3��ѡȡ�����������ݣ����������NaOH��Һ�����ʵ���Ũ��Ϊ________________(С���������λ)��
��4��������Щ������ʹ�ⶨ���ƫ��___________(�����)��
A����ƿ������ˮϴ����ֱ��ע�������Һ���еζ�
B���ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ
C����ʽ�ζ���������ˮϴ�Ӻ�����ȡ��25.00mL����Һע����ƿ�н��еζ�
D���ζ�ǰ���ӵζ��ܶ������ζ���ƽ�ӵζ��ܶ���
��5���ζ��ﵽ�յ�ı�־��_________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com