
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2��aq��+I����aq��![]() I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
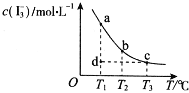
A. ��Ӧ I2��aq��+I����aq��![]() I3����aq����H��0
I3����aq����H��0
B. ���¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K2��K1
C. ��T1ʱ����Ӧ���е�״̬dʱ��һ��������������
D. ״̬a��״̬b��ȣ�״̬bʱI2��ת���ʸ���
���𰸡�C
�����������������A����ͼ�����ߵı仯���ƿ�֪�����¶�����ʱ��I3-�����ʵ���Ũ�ȼ�С��ƽ�������ƶ���˵���÷�Ӧ������ӦΪ���ȷ�Ӧ����H��0������B���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ����¶�Խ�ߣ�ƽ�ⳣ��ԽС����K1��K2������C������Ӧ���е�״̬dʱ����Ӧδ�ﵽƽ��״̬������Ӧ������ƽ�⣬��Ӧ�����ɵ�I3-�����ƶ�����v����v�棬��ȷ��D���¶����ߣ�ƽ�����淽���ƶ���I2��ת���ʽ��ͣ���״̬a��״̬b��ȣ�״̬aʱI2��ת���ʸ��ߣ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯�����˵���������
A.�����ڿ�����ȼ��B.Ũ������������
C.������������D.ʯ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±��ش�������������Ϊ�����µ���������
�� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) |
CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 | H2C2O 4 | K1=5.4��10-2 K2=5.4��10-5 | H2S | K1=1.3��10-7 K2=7.1��10-15 |
HClO | 3��10-8 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO-��HCO3-��CO32-��HC2O4-��ClO-��S2-�н��H+��������������__________��
��2��������0.1 molL-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______�����������
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
��3��0.1 molL-1��H2C2O4��Һ��0.1 molL-1��KOH����Һ�������Ϻ�������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________��
��4��pH��ͬ��NaClO��CH3COOK��Һ������Һ�����ʵ���Ũ�ȵĴ�С��ϵ�ǣ�CH3COONa______NaClO������Һ�У�[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)]���������������=������
��5����0.1 molL-1CH3COOH ��Һ�еμ� NaOH ��Һ�� c(CH3COOH): c(CH3COO-)=5 : 9����ʱ��ҺpH=_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݻ��̶����ܱ������д������·�Ӧ��A��g��+3B��g��![]() 2C��g�� ��H<0ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬������ʵ�������������й�ϵͼ��
2C��g�� ��H<0ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬������ʵ�������������й�ϵͼ��

�����ж���ȷ����
��ͼI�о�����ѹǿ�Է�Ӧ��Ӱ�죬���ҵ�ѹǿ�ϸ�
��ͼII�о�����ѹǿ�Է�Ӧ��Ӱ�죬�Ҽ�ѹǿ�ϸ�
��ͼII�о������¶ȶԷ�Ӧ��Ӱ�죬���ҵ��¶Ƚϸ�
��ͼIII�о����Dz�ͬ�����Է�Ӧ��Ӱ�죬�Ҽ�ʹ�õĴ���Ч�ʽϸ�
A. �٢� B. �٢� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش���������:
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_________________��
��2��C2F4�����ںϳɾ��ķ���ϩ,HBF4������ʴ�̲�����NO2F����������ƽ����е���������NaAlF6��������ұ�����������
��C2F4�������������ۼ���������_____��C2F4������̼ԭ�ӵ��ӻ����������____�����ķ���ϩ��һ�����壬֤�������Ǿ�����õ�ʵ�鷽����_______________��
��HF��BF3���Ͽɵõ�HBF4���Ӽۼ��γɽǶȷ���HF��BF3�ܻ��ϵ�ԭ��_______________��
����NO2F���ӻ�Ϊ�ȵ��ӵķǼ��Է�����__________(дһ������Ҫ��Ļ�ѧʽ����)��
��3��CaF2�ľ���ṹ��ͼ��ʾ��
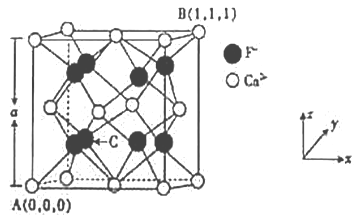
��CaF2�����У�Ca2+����λ��Ϊ_____��F-����λ��Ϊ_____��
��ԭ����������ɱ�ʾ�����ڲ���ԭ�ӵ����λ�ã���֪A��B�����ԭ�����������ͼ��ʾ����C���ԭ���������Ϊ______________��
�۾������������������Ĵ�С����״��CaF2�����ľ���������A=546.2pm�������ܶ�Ϊ_____(�г�����ʽ����)g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��ksp(CaC2O4)=2.4��10-9�������й�0.10mol/L������(Na2C2O4)��Һ��˵������ȷ����
A. ��Һ�и�����Ũ�ȴ�С��ϵc(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
B. ������Һ�в��ϼ�ˮϡ�ͣ���Һ�и�����Ũ�Ⱦ���С
C. ����pH�Ʋ�ô���Һ��pH=a����H2C2O4�ĵڶ�������ƽ�ⳣ��ԼΪKa2=1013-2a
D. �������Һ�м�������CaCl2��Һ���ܹ�������������CaCl2��Һ����СŨ��Ӧ�ô���2.4��10-8mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ķе��Ǽ���:-164��,����-89��,����:-42��,����:36�档�ɴˣ��ƶ϶���ķе���ܣ�
A.����-170��B.ԼΪ-1��C.����36��D.-100��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯���(IiAlH4)���л��ϳ��е���Ҫ��ԭ����ij���������ʵ���Ʊ��⻯��﮲��ⶨ�䴿�ȡ���֪: �⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ��������ͬһ�����塣
�ش���������:
I.�Ʊ��⻯�(IiH)
ѡ��ͼ1�е�װ���Ʊ��⻯�(��Ҫʱ���ظ�ʹ��):
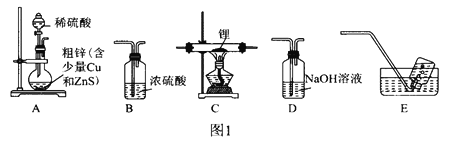
(1)װ��D��NaOH��Һ��������________________________________________��
(2)װ�õ�����˳��(������ʯ)ΪA��__________________________________��
(3)�����װ�õ�����������ȼ�ƾ���ǰ����е�ʵ�������____________________________________��
II.�Ʊ��⻯����
1947 ����Schlesinger��Bond ��Finholt�״��Ƶ��⻯�������䷽����ʹ�⻯�����ˮ���Ȼ������������������л�ϣ����裬��ַ�Ӧ������һϵ�в����õ�LiAlH4���塣
(4)�����ѻ�Ϊȥ����ˮ�Ƿ���������������:____________________________________��
(5)�⻯�����ˮ���Ȼ�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
III.�ⶨ�⻯��﮲�Ʒ(�����⻯�)�Ĵ�����
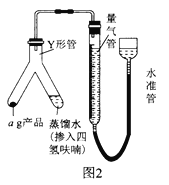
(6)��ͼ2װ�����������װ�������Բ�װ��ԼƷ(Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ�)��������Ӧ�IJ�����_________________������֮ǰ�������ƹ����������Ҳ��������ʹ���������������Һ����ͬһˮƽ��������Ŀ����___________________________��
(7)��״���£���Ӧǰ�����ܶ���ΪV1mL����Ӧ��ϲ���ȴ֮�������ܶ���ΪV2mL������Ʒ�Ĵ���Ϊ_____________________(�ú�a��V1��V2�Ĵ���ʽ��ʾ)������ʼ����ʱ���ӿ̶��ߣ���õĽ����___________(����ƫ������ƫ����������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽�� H2O2��SO2��Br2 ������ǿ����ijС��ͬѧ�������ʵ�����гּ�β������װ������ȥ���������Ѽ�����
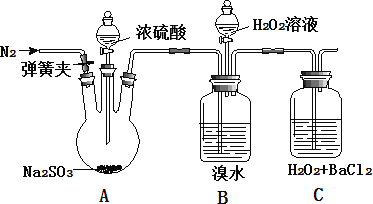
ʵ����� | ʵ������ |
i. �� A �з�Һ©���������μ�Ũ���� | A �������ݲ�����B �к���ɫ��ɫ��C ���а�ɫ���� |
ii. ȡ C �г����������� | C �а�ɫ�������ܽ� |
iii. ��B �з�Һ©����������εμ�H2O2 | ��ʼʱ��ɫ�����Ա仯�������μ� H2O2 ��Һ��һ��ʱ����Һ��ɺ���ɫ |
��1��A �з�����Ӧ�Ļ�ѧ����ʽ��_____��
��2��B �к���ɫ��ɫ�����ӷ���ʽ��_____��
��3����ͬѧͨ�� C �в�����ɫ�������ó������������ԣ�H2O2>SO2��C �в�����ɫ���������ӷ���ʽ��_____��
����ͬѧ��Ϊ���ܵó��˽��ۣ� ��Ϊ�ڵμ�Ũ����֮ǰӦ����һ�������� �ò�����_____��
����ͬѧ��Ϊ��Ӧ���� B �� C ֮������ϴ��ƿ D��D ��ʢ�ŵ��Լ���_____��
�����Һͱ�ͬѧ�Ľ���ķ�������ʵ�飬C �в�����ɫ�������ó����ۣ������� H2O2>SO2��
��4��iii �е������� H2O2 û�����Ա仯��������裺
�۵� 1��H2O2 �����ٲ�������������
�۵� 2��B ����δ��Ӧ SO2
Ϊ��֤�۵� 2��Ӧ���е�ʵ�������������_____��
��5��ͨ������ȫ��ʵ�����ó�������H2O2��SO2��Br2 ��������ǿ������˳����_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com