
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
【答案】 HC2O4- AC c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 5
【解析】本题主要考查弱酸的电离平衡。
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是K最大的微粒H2C2O4电离出H+后的酸根离子HC2O4-。
(2)A.溶液酸性减弱,故A变小;B.电离常数Ka=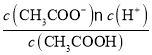 不变,而c(CH3COO-)变小,故B增大;C.c(H+)变小,c(OH-)增大,故C变小;D.增大。故选AC。
不变,而c(CH3COO-)变小,故B增大;C.c(H+)变小,c(OH-)增大,故C变小;D.增大。故选AC。
(3)得到KHC2O4溶液,溶液中的变化: ![]()
![]() H++
H++![]() ,
, ![]() +H2O
+H2O![]() H2C2O4+OH-,H2O
H2C2O4+OH-,H2O![]() H++OH-。该溶液呈酸性,说明HC2O4-的电离程度大于水解程度,该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
H++OH-。该溶液呈酸性,说明HC2O4-的电离程度大于水解程度,该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
(4)由酸性:HClO<CH3COOH可得水解程度:NaClO>CH3COOK,所以pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa>NaClO,两溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(ClO-),c(K+)+c(H+)=c(OH-)+c(CH3COO-),因此,[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)]=c(OH-)-c(H+)。
(5)由Ka(CH3COOH)= 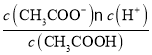 =1.8×10-5和c(CH3COOH):c(CH3COO-)=5:9得c(H+)=1×10-5mol/L,此时溶液pH=5。
=1.8×10-5和c(CH3COOH):c(CH3COO-)=5:9得c(H+)=1×10-5mol/L,此时溶液pH=5。


科目:高中化学 来源: 题型:
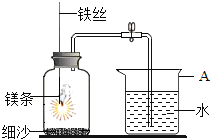
【题目】某学习小组用右图做镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(1)瓶底铺细沙的原因是__________________________________________;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的________%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成推测原因可能是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础
有机物Ⅰ广泛应用在航空、激光等领城,Ⅰ的一种合成路线如下:
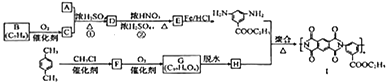
已知:①有机物A的质谱图与核磁共振氢谱图如下:
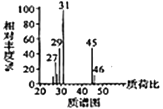
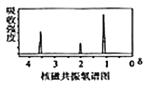
①2RCOOH![]()
![]() +H2O
+H2O
②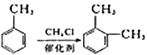
回答下列问题:
(1)A的化学名称是________,C中含氧官能团的名称是________。
(2)②的反应类型为_________,Ⅰ的分子式为_________。
(3)①的反应方程式为_______________________________________。
(4)F的结构简式是______________。
(5)同时满足下列条件的G的同分异构体共有________种(不含立体结构),写出其中的一种结构式:__________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)写出用间二甲苯和甲醇为原料制备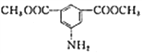 的合成路线:________________(其他试剂任选)。
的合成路线:________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下0.1 molL-1 的NaOH 溶液中,由水电离出的c(OH-)=__________ molL-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HX 的电离常数 Ka=________。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-aKJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bKJ·mol-1 (b>0)
若用标准状况下5. 6LCO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(4)已知AgCl、Ag2CrO4 (砖红色) 的Ksp分别为2×10-10和2.0×10-12。分析化学中,测定含氯的中性溶液中Cl- 的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀_________,当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1) 时,此时溶液中c(CrO42-)等于__________ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是( )
A. 2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
C. C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D. 2FeO+4H2SO4(浓)![]() Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
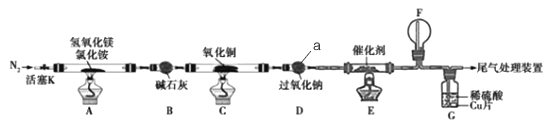
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)![]() I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
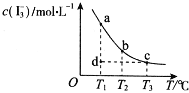
A. 反应 I2(aq)+I﹣(aq)![]() I3﹣(aq)△H>0
I3﹣(aq)△H>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1
C. 若T1时,反应进行到状态d时,一定有υ正>υ逆
D. 状态a与状态b相比,状态b时I2的转化率更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
A. x+y>z B. 平衡向逆反应方向移动
C. B的转化率减小 D. C的体积分数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com