
【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下0.1 molL-1 的NaOH 溶液中,由水电离出的c(OH-)=__________ molL-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HX 的电离常数 Ka=________。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-aKJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bKJ·mol-1 (b>0)
若用标准状况下5. 6LCO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(4)已知AgCl、Ag2CrO4 (砖红色) 的Ksp分别为2×10-10和2.0×10-12。分析化学中,测定含氯的中性溶液中Cl- 的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀_________,当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1) 时,此时溶液中c(CrO42-)等于__________ molL-1。
【答案】 10-11 > (a-0.01)×10-5 0.5 ![]() AgCl 5×10-3
AgCl 5×10-3
【解析】本题主要考查溶液中的离子平衡。
(1)纯水在T℃时,pH=6,则Kw=c(H+)c(OH-)=1×10-12,该温度下0.1 molL-1的NaOH溶液中,由水电离出的c(OH-)=c(H+)=10-11molL-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,说明弱酸盐NaX剩余,则a>0.01;c(H+)=1×10-7molL-1,c(X-)=(a-0.01)/2molL-1,c(HX)=0.01/2molL-1,Ka=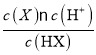 =(a-0.01)×10-5。
=(a-0.01)×10-5。
(3)2①+②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=-(2a+b)KJ·mol-1,若用标准状况下5.6L即0.25molCO将NO2还原至N2(CO完全反应),CO~2e-,则整个过程中转移电子的物质的量为0.5mol,放出的热量为![]() kJ(用含有a和b的代数式表示)。
kJ(用含有a和b的代数式表示)。
(4)c(Cl-)较大,滴定过程中首先析出沉淀AgCl,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,c(Ag+)=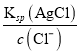 =2.0×10-5mol·L-1,此时溶液中c(CrO42-)=
=2.0×10-5mol·L-1,此时溶液中c(CrO42-)=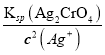 =5×10-3molL-1。
=5×10-3molL-1。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】根据学过的化学知识填空:
(1)金刚石和石墨物理性质差异较大的原因是____________________;一氧化碳和二氧化碳性质不同的原因是_____________________。
(2)天然气的主要成分燃烧的化学方程式是_________________________。
(3)煤在空气中燃烧需要满足的条件是__________;吹灭蜡烛的原理是____________。
(4)生铁和钢都是铁的合金,由于________不同,二者性能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
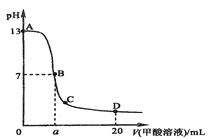
A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,相同浓度的三种一元弱酸(HX、HY、HZ)、强酸、纯水分别用相同浓度的NaOH 溶液滴定,所得溶液的pH 与滴入NaOH 溶液的体积关系如图所示。已知滴定过程中存在:当c(HX)=c(X-) 时,pH=10;c(HY)=c(Y- )时,pH=7;c(HZ)=c(Z-)时,pH=4。下列说法正确的是( )
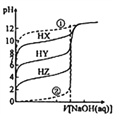
A. ①为强酸的滴定曲线 B. 酸性强弱:HX>HY>HZ
C. 滴定HX溶液可用甲基橙作指示剂 D. HZ+Y-![]() HY+Z-的平衡常数为K=1.0×103
HY+Z-的平衡常数为K=1.0×103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
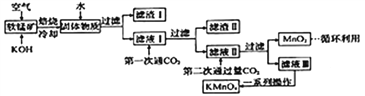
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
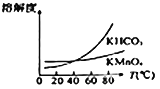
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.Cu2+、SO42﹣、OH﹣、K+
B.Fe3+、NO3﹣、Cl﹣、H+
C.K+、CO32﹣、Cl﹣、H+
D.H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
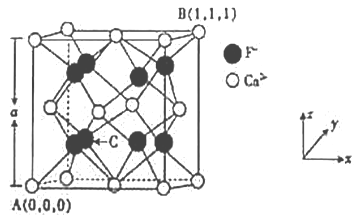
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源的宝库,海水淡化可获得淡水和浓海水。浓海水中主要含有的离子有Na+、 Mg2+ 、Cl﹣、SO42﹣。从浓海水中提取金属镁的一段工艺流程如图所示:
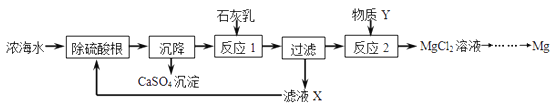
(1)写出反应2的化学方程式:_________________________________________。
(2)操作流程中可循环使用的物质是___________(填化学式)。
(3)在实验室如何证明溶液中的SO42﹣已完全沉淀:_____________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com