
����Ŀ����15mL0.lmol��L-1KOH��Һ����μ���0.2mol��L-1������Һ����ҺpH�ͼ�����ᣨ���ᣩ�������ϵ������ͼ��ʾ�����й�ϵ��ȷ���ǣ� ��
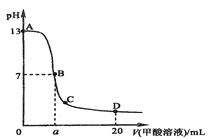
A. ��B�㣺c(K+)=c(HCOO-)��c(OH-)=c(H+)����a=7.5
B. ��A��B������һ�㣬c(HCOO-)��c(K+)��c(OH-)��c(H+)
C. ��D�㣺c(HCOO-)+c(HCOOH)��2c(K+)
D. B��C�Σ�ˮ�ĵ���̶���������С
���𰸡�C
��������
A��B����Һ�����ԣ���c��OH-��=c��H+�����������ǿ�������Σ�Ҫʹ��Һ�����ԣ�������ʵ���Ӧ�������ڼ����a��7.5��A����B����A��B������һ�㣬��Ϊ��ʼʱc��OH-����c��HCOO-������Ҳ�п�����c��K+����c��OH-����c��HCOO-����c��H+����B����C��D�����������������������ʵ���Ϊ0.02L��0.2mol/L��0.004mol��KOH�����ʵ���Ϊ0.015L��0.1mol/L=0.0015mol����Ӧ��c��CH3COO-��+c��CH3COOH����2c��K+����C��ȷ��D���������Ϸ�����֪B������������B��C��ˮ�ĵ���̶���С��D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��Ӧʱ�����������Ƶ����������ص��ǣ� ��
A.�Ƶ��۵��
B.�Ƶ��ܶ�С
C.�Ƶ�Ӳ��С
D.��ǿ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
��CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ��H=+49.0kJ/mol
��CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)��H=-192.9kJ/mol
����˵����ȷ���ǣ� ��
A. CH3OH�ı�ȼ����Ϊ��H=192.9kJ��mol-1
B. ��Ӧ���е������仯��ͼ��ʾ

C. ���ݢ���֪��Ӧ��CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)����H>-192.9kJ/mol
D. CH3OHת���H2�Ĺ���һ��Ҫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ2H2(g)��O2(g)===2H2O(g) ����H����483.6 kJ��mol��1������˵���������ȷ����(����)
A. 2 molˮ�����ֽ�����2 mol������1 mol����������483.6 kJ������
B. 2H2(g)��O2(g)===2H2O(l) ��H>��483.6 kJ��mol��1
C. H2(g)��![]() O2(g)===H2O(g) ��H��241.8 kJ��mol��1
O2(g)===H2O(g) ��H��241.8 kJ��mol��1
D. 1 mol������0.5 mol ����������С��1 molˮ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��ԭ����װ�á���������۵��������������(����)

A. ͼ1��ʾװ�ÿ�ʵ�ּ����������ڹ��������µ�ȡ����Ӧ
B. ͼ2��ʾװ�ÿɷ���CH3CH2OH��CH3COOC2H5�Ļ��Һ
C. ͼ3��ʾװ�ÿ���п����ϡ���ᷴӦ�Ʊ�����
D. ͼ4��ʾװ�ÿ�˵��ŨH2SO4������ˮ�ԡ�ǿ�����ԣ�SO2����Ư���ԡ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,ˮ��ǰ����ɷ���������Ӧ����
A. ���� B. ��ѿ�� C. ���� D. �������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ���������Һ�����ַ�ɢϵ�ĸ��������ǣ� ��
A.���
B.��ɢ�����ӵĴ�С
C.�Ƿ���ͨ����ֽ
D.�Ƿ��ж����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش�����������
��1����ˮ��T��ʱ��pH=6�����¶���0.1 molL-1 ��NaOH ��Һ�У���ˮ�������c(OH-)=__________ molL-1��
��2����25���£���amol��L-1��NaX��Һ��0.01mol��L-1������������ϣ���Ӧ������ҺpH=7����a__________0.01����������������������=�������ú�a�Ĵ���ʽ��ʾHX �ĵ��볣�� Ka=________��
��3��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���塣��֪��
��CO(g)+NO2(g)��NO(g)+CO2(g) ��H=-aKJ��mol-1 (a��0)
��2CO(g)+2NO(g)��N2(g)+2CO2(g) ��H=-bKJ��mol-1 (b��0)
���ñ�״����5. 6LCO��NO2��ԭ��N2��CO��ȫ��Ӧ����������������ת�Ƶ��ӵ����ʵ���Ϊ_____ mol���ų�������Ϊ_________ kJ���ú���a��b�Ĵ���ʽ��ʾ����
��4����֪AgCl��Ag2CrO4 (ש��ɫ) ��Ksp�ֱ�Ϊ2��10-10��2.0��10-12��������ѧ�У��ⶨ���ȵ�������Һ��Cl- �ĺ�������K2CrO4��ָʾ������AgNO3��Һ�ζ����ζ�������������������_________������Һ��Cl- ǡ����ȫ������Ũ�ȵ���1.0��10-5 mol��L-1�� ʱ����ʱ��Һ��c(CrO42-)����__________ molL-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2HI��g��![]() H2��g��+I2��g���У����ַ��ӻ�ѧ������ʱ�����仯��ͼ1��ʾ������������ͬ��1 mol HI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��I2���ʵ������¶ȱ仯��������ͼ2��ʾ��
H2��g��+I2��g���У����ַ��ӻ�ѧ������ʱ�����仯��ͼ1��ʾ������������ͬ��1 mol HI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��I2���ʵ������¶ȱ仯��������ͼ2��ʾ��
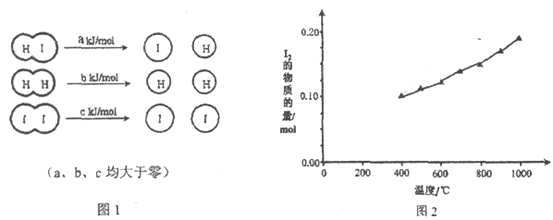
��1���Ƚ�2a________b+c���<������>����=������������________________��
��2��ij�¶��¸÷�Ӧƽ�ⳣ��Ϊ1��64����ƽ��ʱ��1 mol HI�ֽ��ת����Ϊ________________��
��3�������ô˷�Ӧ�Ʊ�I2�������HIת���ʵĴ�ʩ��________������ĸ��ţ���
a. ����I2 b. ��ѹ c. ���� d. ����HIŨ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com