
【题目】溶液、胶体和浊液这三种分散系的根本区别是( )
A.外观
B.分散质粒子的大小
C.是否能通过滤纸
D.是否有丁达尔效应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
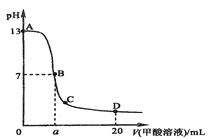
A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是

A. 右室电极为该电池的正极
B. 左室电极反应式可表示为:C6H5OH-28e-+11H2O=6CO2↑+28H+
C. 右室电极附近溶液的pH减小
D. 工作时左侧离子交换膜为阴离子交换膜,右侧离子交换膜为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,相同浓度的三种一元弱酸(HX、HY、HZ)、强酸、纯水分别用相同浓度的NaOH 溶液滴定,所得溶液的pH 与滴入NaOH 溶液的体积关系如图所示。已知滴定过程中存在:当c(HX)=c(X-) 时,pH=10;c(HY)=c(Y- )时,pH=7;c(HZ)=c(Z-)时,pH=4。下列说法正确的是( )
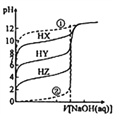
A. ①为强酸的滴定曲线 B. 酸性强弱:HX>HY>HZ
C. 滴定HX溶液可用甲基橙作指示剂 D. HZ+Y-![]() HY+Z-的平衡常数为K=1.0×103
HY+Z-的平衡常数为K=1.0×103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
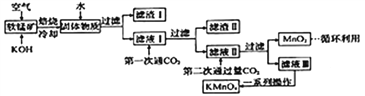
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
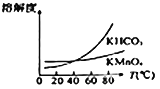
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.Cu2+、SO42﹣、OH﹣、K+
B.Fe3+、NO3﹣、Cl﹣、H+
C.K+、CO32﹣、Cl﹣、H+
D.H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸)或c(H+) | c(NaOH)/mol/L | 混合溶液的pH |
甲 | c(H+)=0.1 mol/L的HX酸 | 0.1 | pH=a |
乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
丙 | c(HZ)=0.1 mol/L | 0.1 | pH=9 |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY溶液的pH=______。
(3)丙组实验发生反应的离子方程式为__________________,
所得溶液中由水电离出的c(OH-)=______mol/L。
II. 将0.1 mol·L-1 NaOH溶液分别滴入体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HA溶液,溶液的pH随加入NaOH溶液体积变化如图:
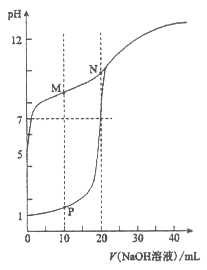
(1)HA为_______酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用离子方程式表示)_________。
(3)下列说法正确的是_______ (填字母)。
a. M点c(HA)-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
(4)NaA与NaOH等浓度等体积混合时,溶液中c(A-)______c(OH-)(填“<”,“=”或“>”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com